Einleitung
Die Newman-Projektion ist eine Darstellungsweise, mit der
ein dreidimensionales Molekül zweidimensional abgebildet werden kann.
Das Molekül wird entlang der Rotationsachse einer Bindung zwischen zwei Atomen
betrachtet. Die Bindungen von diesen Atomen zu Nachbaratomen werden durch Striche
dargestellt. Mit Hilfe der Newman-Projektion lässt sich die
Konformation eines Moleküls gut darstellen.
Erklärung
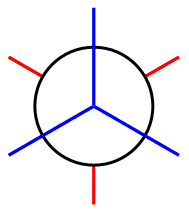 Bei der Newman-Projektion wird das zum Betrachter zeigende Kohlenstoffatom
durch einen Kreis dargestellt. Ausgehend von dem Zentrum des
Kohlenstoffatomes bzw. Kreises gehen die drei Einfachbindungen
(hier in blau)
zu den Substituenten ab. Das hintere Kohlenstoffatom wird von
dem vorderen verdeckt, deswegen sieht man nur die Teile der
Bindungen (hier in rot), die aus dem Kreis herausragen.
Die Newman-Projektion kann durch eine Änderung des Betrachtungswinkels leicht aus der
Sägebock-Projektion
hergeleitet werden.
Nachfolgend ist diese Überführung beispielhaft dargestellt.
Bei der Newman-Projektion wird das zum Betrachter zeigende Kohlenstoffatom
durch einen Kreis dargestellt. Ausgehend von dem Zentrum des
Kohlenstoffatomes bzw. Kreises gehen die drei Einfachbindungen
(hier in blau)
zu den Substituenten ab. Das hintere Kohlenstoffatom wird von
dem vorderen verdeckt, deswegen sieht man nur die Teile der
Bindungen (hier in rot), die aus dem Kreis herausragen.
Die Newman-Projektion kann durch eine Änderung des Betrachtungswinkels leicht aus der
Sägebock-Projektion
hergeleitet werden.
Nachfolgend ist diese Überführung beispielhaft dargestellt.

Beispiel: antiperiplanare Konformation des Butanmoleküls
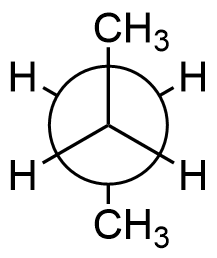 Will man das Butanmolekül in der Newman-Projektion darstellen, so
betrachtet man das Molekül entlang der Einfachbindung zwischen
Kohlenstoffatom Nr. 2 und 3, an denen sich jeweils zwei
Wasserstoffatome und eine Methylgruppe befindet.
Die antiperiplanare Konformation des Butanmoleküls ist gekennzeichnet
durch die beiden um 180° zueinander verdrehten Methylgruppen. Sie
stellt die energetisch günstigste Konformation des Butanmoleküls dar,
da die beiden sterisch anspruchsvollen Methylgruppen bei dieser
Konformation am weitesten voneinander entfernt sind.
Will man das Butanmolekül in der Newman-Projektion darstellen, so
betrachtet man das Molekül entlang der Einfachbindung zwischen
Kohlenstoffatom Nr. 2 und 3, an denen sich jeweils zwei
Wasserstoffatome und eine Methylgruppe befindet.
Die antiperiplanare Konformation des Butanmoleküls ist gekennzeichnet
durch die beiden um 180° zueinander verdrehten Methylgruppen. Sie
stellt die energetisch günstigste Konformation des Butanmoleküls dar,
da die beiden sterisch anspruchsvollen Methylgruppen bei dieser
Konformation am weitesten voneinander entfernt sind.
Alle weiteren Konformationen des Butanmoleküls lassen sich unter
dem Lernmodul
scheLM 3D Butan sowie im Glossar
nachschlagen.
 Bei der Newman-Projektion wird das zum Betrachter zeigende Kohlenstoffatom
durch einen Kreis dargestellt. Ausgehend von dem Zentrum des
Kohlenstoffatomes bzw. Kreises gehen die drei Einfachbindungen
(hier in blau)
zu den Substituenten ab. Das hintere Kohlenstoffatom wird von
dem vorderen verdeckt, deswegen sieht man nur die Teile der
Bindungen (hier in rot), die aus dem Kreis herausragen.
Die Newman-Projektion kann durch eine Änderung des Betrachtungswinkels leicht aus der
Sägebock-Projektion
hergeleitet werden.
Nachfolgend ist diese Überführung beispielhaft dargestellt.
Bei der Newman-Projektion wird das zum Betrachter zeigende Kohlenstoffatom
durch einen Kreis dargestellt. Ausgehend von dem Zentrum des
Kohlenstoffatomes bzw. Kreises gehen die drei Einfachbindungen
(hier in blau)
zu den Substituenten ab. Das hintere Kohlenstoffatom wird von
dem vorderen verdeckt, deswegen sieht man nur die Teile der
Bindungen (hier in rot), die aus dem Kreis herausragen.
Die Newman-Projektion kann durch eine Änderung des Betrachtungswinkels leicht aus der
Sägebock-Projektion
hergeleitet werden.
Nachfolgend ist diese Überführung beispielhaft dargestellt.

 Will man das Butanmolekül in der Newman-Projektion darstellen, so
betrachtet man das Molekül entlang der Einfachbindung zwischen
Kohlenstoffatom Nr. 2 und 3, an denen sich jeweils zwei
Wasserstoffatome und eine Methylgruppe befindet.
Die antiperiplanare Konformation des Butanmoleküls ist gekennzeichnet
durch die beiden um 180° zueinander verdrehten Methylgruppen. Sie
stellt die energetisch günstigste Konformation des Butanmoleküls dar,
da die beiden sterisch anspruchsvollen Methylgruppen bei dieser
Konformation am weitesten voneinander entfernt sind.
Will man das Butanmolekül in der Newman-Projektion darstellen, so
betrachtet man das Molekül entlang der Einfachbindung zwischen
Kohlenstoffatom Nr. 2 und 3, an denen sich jeweils zwei
Wasserstoffatome und eine Methylgruppe befindet.
Die antiperiplanare Konformation des Butanmoleküls ist gekennzeichnet
durch die beiden um 180° zueinander verdrehten Methylgruppen. Sie
stellt die energetisch günstigste Konformation des Butanmoleküls dar,
da die beiden sterisch anspruchsvollen Methylgruppen bei dieser
Konformation am weitesten voneinander entfernt sind.