Einleitung
Cycloalkane besitzen eine
Ringspannung. Diese kann sich aus drei Anteilen zusammensetzen.
Dies sind die
Baeyer-Spannung, die Pitzer-Spannung
und die Prelog-Spannung.
Die Pitzer-Spannung, oder auch Torsionsspannung oder
konformative Spannung beruht auf
der Tatsache, dass sich häufig in einem Ring nur eine ungünstige
Konformation ausbilden kann.
Dies sieht man besonders gut, wenn man die Anordnung in Cycloalkanen mit
den Anordnungen in Ethan und Butan vergleicht.
Ethan
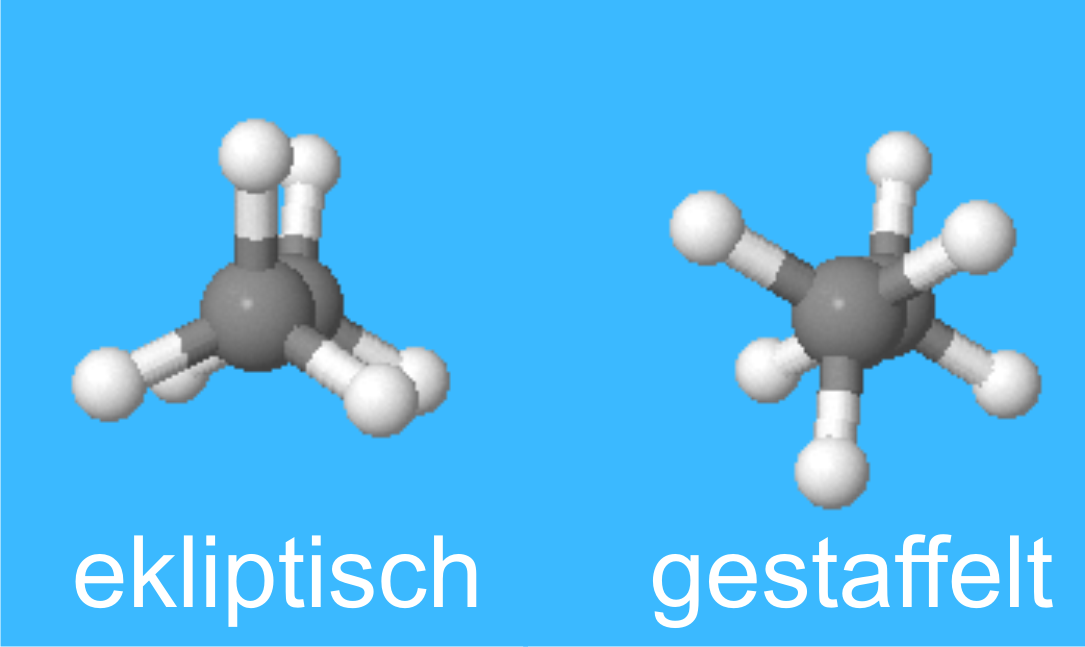 Im Ethan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version) könen zwei Anordnungen unterschieden werden, die gestaffelte (bei der
die Wasserstoffatome an den beiden Kohlenstoffatomen auf Lücke stehen)
und die ekliptische (bei der die Wasserstoffatome an den beiden Kohlenstoffatomen
exakt hintereinander stehen).
Im Ethan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version) könen zwei Anordnungen unterschieden werden, die gestaffelte (bei der
die Wasserstoffatome an den beiden Kohlenstoffatomen auf Lücke stehen)
und die ekliptische (bei der die Wasserstoffatome an den beiden Kohlenstoffatomen
exakt hintereinander stehen).
Die gestaffelte Anordnung ist güenstiger. Dies beruht auf Orbitalwechselwirkungen,
kann aber auch durch die sterische Wechselwirkung der Wasserstoffatome
rationalisiert werden.
Butan
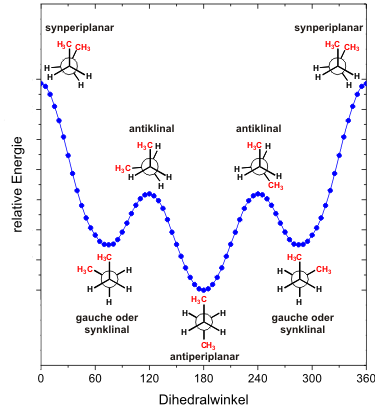 Im Butan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version)
ist die Situation komplizierter. Es gibt zwei ekliptische und zwei
gestaffelte Anordnungen.
Im Butan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version)
ist die Situation komplizierter. Es gibt zwei ekliptische und zwei
gestaffelte Anordnungen.
Bei den beiden gestaffelten Anordnungen handelt es sich um die
energiegüstigste antiperiplanare Anordnung und um die
synklinale Anordnung, die auch als gauche bezeichnet wird.
Die beiden eklipischen Anordnungen, die synperiplanare
und die antiklinale sind deutlich energiereicher und damit
ungünstiger
Cyclopropan
Im Cyclopropan müssen aus geometrischen Gründen alle
Wasserstoffatome ekliptisch stehen. Dies ist energetisch ungünstig
und führt zur Pitzerspannung/konformative Spannung. Diese
Pitzerspannung addiert sich zu der abenfalls vorhandenen Baeyerspannung.
Cyclobutan
 Auch im Cyclobutan tritt Pitzer-Spannung auf. Auch hier muss
diese zur ebenfalls vorhandenen Baeyer-Spannung addiert werden. Aufgrund der
Baeyer-Spannung sollte Cyclobutan planar sein (So ergibt sich ein
C-C-C-Winkel von 90°). Dies führt aber dazu, dass alle Wasserstoffatome
perfekt ekliptisch stehen. Dies wiederum bedeutet, dass die Pitzer-Spannung
groß wird. Um dieser großen Pitzer-Spannung auszuweichen ist
ein Cyclobutan-Ring leicht gewinkelt. Dies reduziert die Pitzer-Spannung,
gleichzeitig steigt aber die Baeyer-Spannung.
Auch im Cyclobutan tritt Pitzer-Spannung auf. Auch hier muss
diese zur ebenfalls vorhandenen Baeyer-Spannung addiert werden. Aufgrund der
Baeyer-Spannung sollte Cyclobutan planar sein (So ergibt sich ein
C-C-C-Winkel von 90°). Dies führt aber dazu, dass alle Wasserstoffatome
perfekt ekliptisch stehen. Dies wiederum bedeutet, dass die Pitzer-Spannung
groß wird. Um dieser großen Pitzer-Spannung auszuweichen ist
ein Cyclobutan-Ring leicht gewinkelt. Dies reduziert die Pitzer-Spannung,
gleichzeitig steigt aber die Baeyer-Spannung.
Cyclopentan
 Aus analogen Gründen ist auch Cyclopentan nicht planar.
Cyclopentan existiert in einer Envelop-Konformation
(Envelop = Briefumschlag). Durch diese Anordung wird wieder die Pitzer-Spannung reduziert,
wärend gleichzeitig die Baeyer-Spannung steigt. Die Envelop-Konformation
ist flexibel. Bei Raumtemperatur ändert sich die Anordnung ständig
und es steht immer eine andere Ecke oben/unten.
Aus analogen Gründen ist auch Cyclopentan nicht planar.
Cyclopentan existiert in einer Envelop-Konformation
(Envelop = Briefumschlag). Durch diese Anordung wird wieder die Pitzer-Spannung reduziert,
wärend gleichzeitig die Baeyer-Spannung steigt. Die Envelop-Konformation
ist flexibel. Bei Raumtemperatur ändert sich die Anordnung ständig
und es steht immer eine andere Ecke oben/unten.
Cyclohexan
 Im Cyclohexan gibt es eine Reihe von Konformationen, so dass die
Situation komplex ist. Dies wird ausführlich in einem eigenen Lernmodul
(JAVA
oder
JavaScript
Version)
diskutiert. Auf die stabilste Konformation, die Sesselkonformation soll
hier kurz eingegangen werden.
Im Cyclohexan gibt es eine Reihe von Konformationen, so dass die
Situation komplex ist. Dies wird ausführlich in einem eigenen Lernmodul
(JAVA
oder
JavaScript
Version)
diskutiert. Auf die stabilste Konformation, die Sesselkonformation soll
hier kurz eingegangen werden.
In der Sesselkonformation stehen die alle Wasserstoffatome ekliptisch.
Dies kann man in der abbildung für die blau-rote-Bindung und die
orange-grüne-Bindung gut erkennen. Die Anordnung enspricht der
synklinalen Anordnung im Butan.
größere Ringe
In größeren Ringen ist die Situation kompliziert und soll
hier nicht weiter diskutiert werden.
 Im Ethan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version) könen zwei Anordnungen unterschieden werden, die gestaffelte (bei der
die Wasserstoffatome an den beiden Kohlenstoffatomen auf Lücke stehen)
und die ekliptische (bei der die Wasserstoffatome an den beiden Kohlenstoffatomen
exakt hintereinander stehen).
Im Ethan (siehe das entsprechende Lernmodul in der
JAVA
oder
JavaScript
Version) könen zwei Anordnungen unterschieden werden, die gestaffelte (bei der
die Wasserstoffatome an den beiden Kohlenstoffatomen auf Lücke stehen)
und die ekliptische (bei der die Wasserstoffatome an den beiden Kohlenstoffatomen
exakt hintereinander stehen). Im Butan (siehe das entsprechende Lernmodul in der
Im Butan (siehe das entsprechende Lernmodul in der
 Auch im Cyclobutan tritt Pitzer-Spannung auf. Auch hier muss
diese zur ebenfalls vorhandenen Baeyer-Spannung addiert werden. Aufgrund der
Baeyer-Spannung sollte Cyclobutan planar sein (So ergibt sich ein
C-C-C-Winkel von 90°). Dies führt aber dazu, dass alle Wasserstoffatome
perfekt ekliptisch stehen. Dies wiederum bedeutet, dass die Pitzer-Spannung
groß wird. Um dieser großen Pitzer-Spannung auszuweichen ist
ein Cyclobutan-Ring leicht gewinkelt. Dies reduziert die Pitzer-Spannung,
gleichzeitig steigt aber die Baeyer-Spannung.
Auch im Cyclobutan tritt Pitzer-Spannung auf. Auch hier muss
diese zur ebenfalls vorhandenen Baeyer-Spannung addiert werden. Aufgrund der
Baeyer-Spannung sollte Cyclobutan planar sein (So ergibt sich ein
C-C-C-Winkel von 90°). Dies führt aber dazu, dass alle Wasserstoffatome
perfekt ekliptisch stehen. Dies wiederum bedeutet, dass die Pitzer-Spannung
groß wird. Um dieser großen Pitzer-Spannung auszuweichen ist
ein Cyclobutan-Ring leicht gewinkelt. Dies reduziert die Pitzer-Spannung,
gleichzeitig steigt aber die Baeyer-Spannung.
 Aus analogen Gründen ist auch Cyclopentan nicht planar.
Cyclopentan existiert in einer Envelop-Konformation
(Envelop = Briefumschlag). Durch diese Anordung wird wieder die Pitzer-Spannung reduziert,
wärend gleichzeitig die Baeyer-Spannung steigt. Die Envelop-Konformation
ist flexibel. Bei Raumtemperatur ändert sich die Anordnung ständig
und es steht immer eine andere Ecke oben/unten.
Aus analogen Gründen ist auch Cyclopentan nicht planar.
Cyclopentan existiert in einer Envelop-Konformation
(Envelop = Briefumschlag). Durch diese Anordung wird wieder die Pitzer-Spannung reduziert,
wärend gleichzeitig die Baeyer-Spannung steigt. Die Envelop-Konformation
ist flexibel. Bei Raumtemperatur ändert sich die Anordnung ständig
und es steht immer eine andere Ecke oben/unten.
 Im Cyclohexan gibt es eine Reihe von Konformationen, so dass die
Situation komplex ist. Dies wird ausführlich in einem eigenen Lernmodul
(
Im Cyclohexan gibt es eine Reihe von Konformationen, so dass die
Situation komplex ist. Dies wird ausführlich in einem eigenen Lernmodul
(