Prinzipien der Organischen Chemie
Die Vorlesung Prinzipien der Organischen Chemie ist die erste Vorlesung zur organischen Chemie für Studierende der Biochemie, Chemie und Wirtschaftschemie an der Heinrich-Heine-Universität Düsseldorf. Im Rahmen dieser Vorlesung werden die ersten Grundlagen zur organischen Chemie vermittelt.
Zunächst soll die Frage beantwortet werden, wie der Begriff
organische Chemie definiert ist. Jöns Jakob Berzelius
unterschied zwischen organischen und anorganischen Stoffen. Er glaubte,
dass organische Soffe nur duch eine besondere "Lebenskraft" geschaffen
werden könnten.
Im Jahr 1828 erhitzte Friedrich Wöhler Ammoniumcyanat, eine
typische anorganische Verbindung. Unter Umlagerung entsteht bei diesem
Vorgang Harnstoff, eine typische organische Verbindung. Damit war die
These von der besonderen "Lebenskraft" wiederlegt.
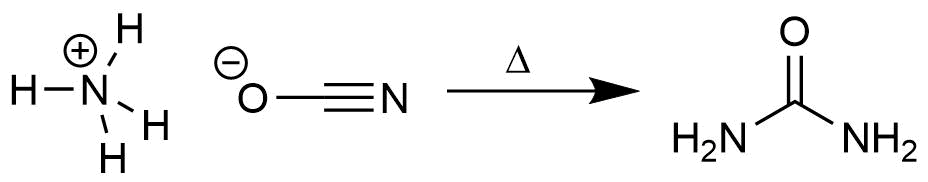
Synthese von Harnstoff aus Ammoniumcyanat
Mit dieser Entdeckung war die oben gegebene Definition nicht mehr haltbar. Eine neue Definition musste gefunden werden.
Die organische Chemie ist die Chemie der Verbindungen des Kohlenstoffs, ausgenommen der Carbonate und ihrer Derivate.
Diese Definiton gibt dem Kohlenstoff eine eine ganz besondere Rolle
in der Chemie.
Die Gründe werden auf den nächsten Seiten erläutert.
Strukturelle Vielfalt I
Kohlenstoff ist wie kein anderes Element in der Lage, kovalente Bindungen mit sich selbst und mit anderen Elementen zu bilden. Betrachtet man nur die Kohlenwasserstoffe (Verbindungen aus Kohlenstoff und Wasserstoff), so ist bereits eine unendliche strukturelle Vielfalt möglich.
Dies ist im Folgenden für einfache Alkane gezeigt. Der Begriff Alkan
wird später noch definiert. Wichtig ist hier, dass es sich um Systeme
handelt, in denen es nur C-C- und C-H-Einfachbindungen gibt. Für
solche Systeme gilt abhängig von der Kohlenstoffzahl die Summenformel:
CnH2n+2.
In der folgenden Tabelle sind die Alkane für n = 1 bis 6 aufgefürt.
Aufgabe: Betrachten Sie die Anzahl der möglichen Strukturen für n ≥ 4.
| Anzahl C-Atome |
Summen- formel |
Struktur 1 | Struktur 2 | Struktur 3 |
| 1 | CH4 |
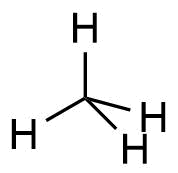
Methan |
||
| 2 | C2H6 |
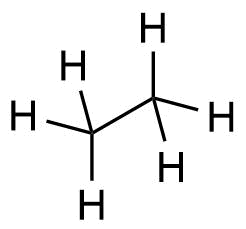 Ethan |
||
| 3 | C3H8 |
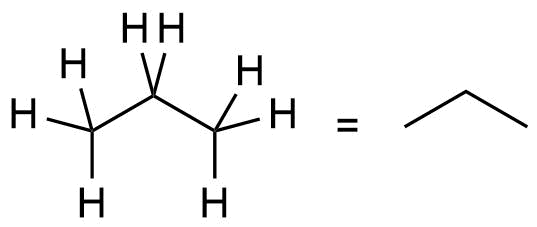 Propan |
||
| 4 | C4H10 |
 Butan |
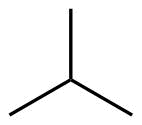 Methylpropan |
|
| 5 | C5H12 |
 Pentan |
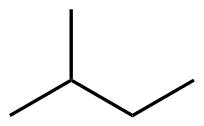 Methylbutan |
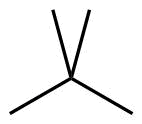 Dimethylpropan |
| 6 | C6H14 |
 Hexan |
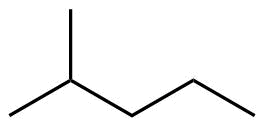 2-Methylpentan |
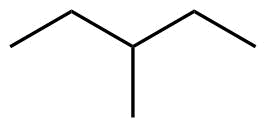 3-Methylpentan |
| Struktur 4 | Struktur 5 | |||
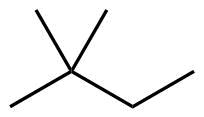 2,2-Dimethylbutan |
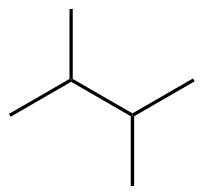 2,3-Dimethylbutan |
Beobachtung: Die Anzahl der möglichen Strukturen steigt mit der Anzahl der Kohlenstoffatome.
Auf der nächsten Seite findet Ihr weitere Details!
Konstitutionsisomere
In der Tabelle auf der vorherigen Seite sind alle möglichen Strukturen mit der Summenformel CnH2n+2 für n = 1, 2, 3, 4, 5, 6 aufgeführt. Für n ≥ 4 sind bei gleicher Summenformel verschiedene Strukturen möglich. In diesem Fall spricht man von Konstitutionsisomeren.
Verbindungen mit gleicher Summenformel, aber unterschiedlicher Verknüpfung der Atome, nennt man Konstitutionsisomere.
Die verschiedenen Arten der Isomere (Konstitutionsisomerie, Stereoisomere, ...) werden später ausführlich diskutiert.
In der folgenden Tabelle ist die maximal mögliche Anzahl Konstitutionsisomere für verschiedene Summenformeln gegeben.
| Summenformel | Anzahl Konstitutionsisomere |
| CH4 | 1 |
| C2H6 | 1 |
| C3H8 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
| C11H24 | 159 |
| C12H26 | 355 |
| C20H42 | 366 319 |
| C30H62 | 4 111 846 763 |
Dies zeigt eindrucksvoll, wie groß die Anzahl der möglichen Strukturen schon bei relativ wenigen Kohlenstoff- und Wasserstoffatomen ist. Da nur Kohlenstoff in diesem Maße in der Lage ist, mit sich selbst Bindungen einzugehen, ist eine solche strukturelle Vielfallt nur beim Kohlenstoff möglich.
Diese strukturelle Vielfalt wächst weiter, wenn
auch Verbindungen mit weniger Wasserstoffatomen bei
gleicher Kohlenstoffzahl berücksichtigt werden.
Dies ist auf der nächsten Seite gezeigt.
Strukturelle Vielfalt II
Neben den auf den vorangegangenen Seiten diskutierten Alkanen, gibt es auch Cycloalkane. Entfernt man von beiden Enden des Propans ein Wasserstoffatom und bildet stattdessen eine neue Kohlenstoff-Kohlenstoffbindung so entsteht eine cyclische (ringförmige) Verbindung, in diesem Fall Cyclopropan.

Propan C3H8 |

Cyclopropan C3H6 |
Es gibt aber auch eine offenkettige Verbindung mit der Summenformel C3H6. Auch hier werden zwei Wasserstoffatome aus Propan entfernt. Es entsteht aber nicht Cyclopropan, sondern Propen - ein Molekül mit einer Doppelbindung. Die beiden Wasserstoffatome werden formal von benachbarten Kohlenstoffatomen entfernt.

Propan C3H8 |
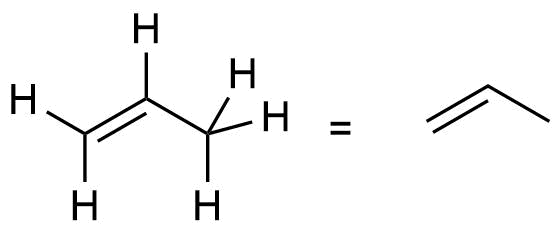
Propen C3H6 |
Dieses Beispiel zeigt, dass es für die Summenformel C3H8 nur ein Isomer* gibt (siehe vorherige Seite), für die Summenformel C3H6 (Zwei Wasserstoffatome weniger) dagegen schon zwei Isomere*.
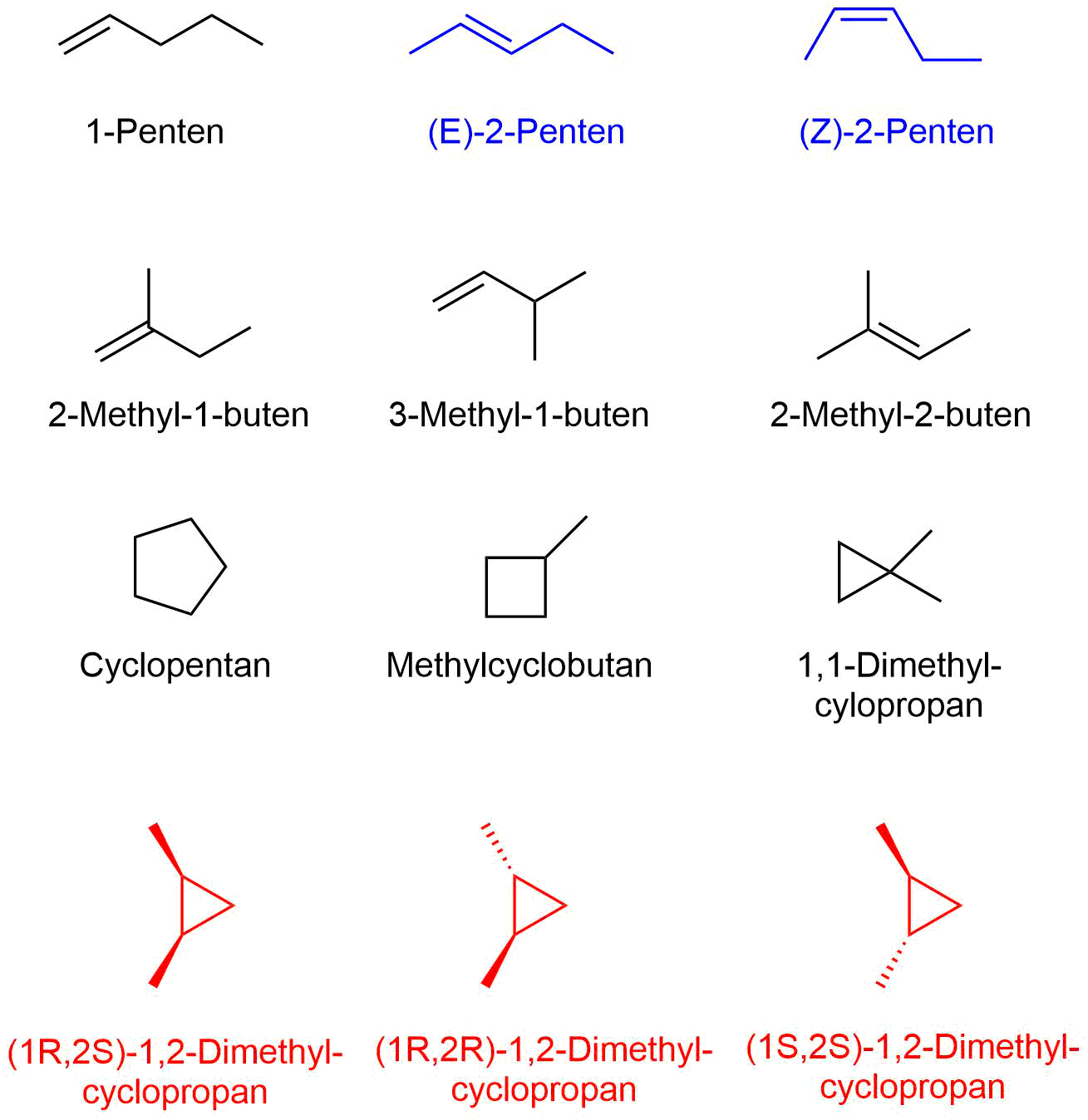
Noch deutlicher wird dies für das Beispiel mit fünf
Kohlenstoffatomen. Für C5H12 sind nur drei
 Konstitutionsisomere*
möglich, für C5H10
gibt es insgesamt zwölf Isomere*.
Konstitutionsisomere*
möglich, für C5H10
gibt es insgesamt zwölf Isomere*.
Bei den beiden blauen Isomeren* handelt es sich um Konfigurationsisomere*
(die Konstitution ist aber gleich). Auch die drei roten Verbindungen
bilden Konfigurationsisomere* (auch hier ist die Konstitution gleich).
Es gibt also für C5H10 neun Konstitutionsisomere*,
eines wird durch die beiden blauen Konfigurationsisomere* gebildet, das zweite
durch die drei roten Konfigurationsisomere* und sieben weitere durch die
sieben schwarzen Strukturen.
Zusammenfassung: Für Verbindungen vom Typ C5H10 gibt es neun Konstitutionsisomere* und zwölf Isomere* insgesamt, verglichen mit drei Isomeren für Verbindungen vom Typ C5H12 (alles Konstitutionsisomere*).
* Die verschiedenen Isomeriebegriffe (Isomere, Konstitutionsisomere, Konfigurationsisomere, ...) werden später ausführlich diskutiert.
Hier fehlt ein Link
Diese strukturelle Vielfalt steigt weiter, wenn man auch
andere Elemente als Wassetstoff und Kohlenstoff
berücksichtigt.
Dies ist auf der nächsten Seite gezeigt.
Funktionelle Gruppen
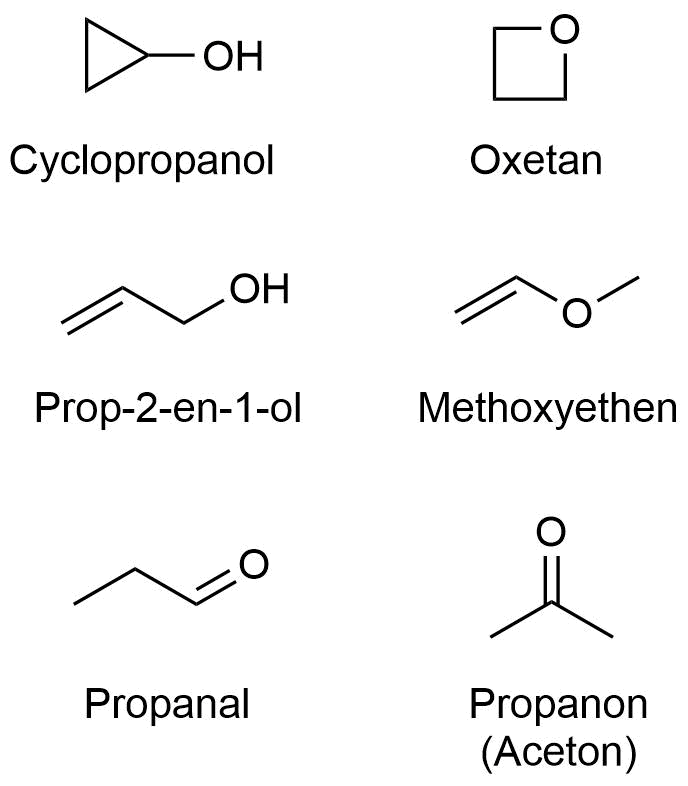
Auf den vorangegangen Seiten haben Sie gesehen, dass schon für eine relativ kleine Anzahl von Atomen selbst bei reinen Kohlenwasserstoffen eine kaum überschaubare Vielfalt an Isomeren möglich ist.
Das Periodensystem (siehe scheLM PSE) enthält neben Kohlenstoff und Wasserstoff 116 weitere Elemente. Darunter befinden sich kurzlebige Elemente und Edelgase, aber viele dieser Elemente haben auch eine Bedeutung in der organischen Chemie.
Selbst wenn man nur ein Element hinzunimmt, steigert sich die Vielfallt an denkbaren Isomeren schnell. Auf der vorherigen Seite haben wir gesehen, dass es zwei Isomere zur Summenformel C3H6 gibt. Zur Summenformel C3H6O (ein zusätzliches Sauerstoffatom) gibt es bereits 6 Isomere (siehe Bild rechts).
Dies zeigt, dass sich eine ungehäure strukturelle Vielzahl von Verbindungen erdenken lässt. 2012 waren bereits 40 Millionen Verbindungen bekannt und die Zahl wächst rasant.
Die große Herausforderung für den organischen Chemiker ist die gezielte Synthese und anschließende Chrakterisierung immer neuer Derivate für spezielle Anwendungen.
Im nächsten Kapitel findet Ihr eine kurze historische Übersicht zu den Anfängen der organischen Chemie.