Erste Anfänge
Schon Aristoteles (384 v. Chr. - 322 v. Chr.) unterschied die Welt in drei Naturreiche, das mineralische (Mineralien und Gesteine), das vegetabilische (pflanzliches Leben) und das animalische (tierisches Leben). Diese Unterscheidung in die unbelebte (mineralische) und die belebte (vegetabilische und animalische) Natur bestimmte für mehr als 2000 Jahre unser Denken.
Einen weiteren wichtigen Meilenstein stellten die Arbeiten von Antoine Laurent de Lavosier (1743 - 1794) da. Er führte den modernen Elementbegriff ein und leistete große Beiträge zur Entwicklung der Analyse (Zerlegung von Verbindungen in die Elemente).
Zur gleichen Zeit gelang es Carl Wilhelm Scheele (1742 - 1786) erste reine Stoffe aus Lebewesen zu isolieren.
In der Folge definierte Jöns Jakob Berzelius (1779 - 1848) den Begriff Organische Chemie. Nach seiner Definition zeichnen sich organische Moleküle dadurch aus, dass sie nur durch die "vis vitalis", die Lebenskraft, geschaffen werden können. Damit unterschied Berzelius, wie schon Aristoteles 2000 Jahre vor ihm, zwischen belebter und unbelebter Natur.
Diese Definition behielt bis zu den im vorangegangenen Kapitel erwähnten Experiment von Wöhler ihre Gültigkeit.
Auf der nächsten Seite erfahrt Ihr mehr zu Wöhler und Liebig, den Gründern der organischen Chemie.
Wöhler und Liebig

Wöhler
Bildquelle
Dadurch eröffnete sich ein vollkommen neues Forschungsgebiet.
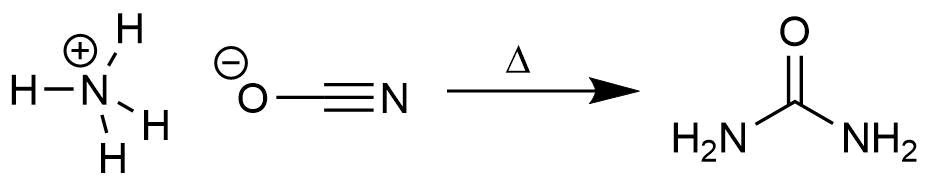
Synthese von Harnstoff aus Ammoniumcyanat

Liebig
Bildquelle

Fünfkugelapparat
Bildquelle
Das Bild rechts zeigt den Fünfkugelapparat zur Adsorption des CO2 aus einer verbrannten organischen Probe. Die ACS (American Chemical Society) führt den Fünfkugelapparat nach Justus von Liebig in ihrem Logo.
Mehr zur Elementaranalyse erfahren Sie im entsprechenden Kapitel (in Vorbereitung).
Nun war es möglich die Zusammensetzung einer Verbindung aus den Elementen, zu bestimmen. Vieles über die Natur der chemischen Bindung war aber unbekannt. Dazu mehr auf der folgenden Seite.
Der vierbindige Kohlenstoff

Van 't Hoff
Bildquelle
Im Jahr 1858 entwickelten Archibald Scott Couper (1831 - 1892) und Friedrich August Kekule (1829 - 1896) unabhängig voneinander eine chemische Bindungstheorie. Auch wenn sich beide Theorien unterschieden, so gibt es zwei wichtige Gemeinsamkeiten:
- Kohlenstoff ist (in der Regel) in der Lage, vier Bindungen einzugehen.
- Kohlenstoff kann mit sich selbst Bindungen eingehen.
Diese beiden Aussagen führen zu der diskutierten strukturellen Vielfalt organischer Moleküle.
Der nächste wichtige Schritt in der Entwicklung der organischen Chemie waren Arbeiten von Jacobus Henricus van 't Hoff. Auch wenn 't Hoff mehr für seine Beiträge zur physikalischen Chemie berühmt wurde (Nobelpreis 1901, erster Nobelpreisträger für Chemie), so hat er auch bedeutende Beiträge zur organischen Chemie geleistet.
Es war bekannt, dass ein Kohlenstoffatom, welches vier verschiedene Reste trägt, in zwei isomeren Formen vorkommen kann. Diese beiden Formen drehen die Ebene von polarisierten Licht um den gleichen Betrag, aber in unterschiedliche Richtungen. Es gibt also eine Bild-Spiegelbild-Beziehung. Aus dieser Beobachtung schloss van 't Hoff, dass es auch für die beiden Isomere eine Bild-Spiegeilbild Beziehung geben muss. Er erkannte, dass die vier Reste das Kohlenstoffatom dann tetraedrisch umgeben müssen. Nur so konnte er den beobachteten Effekt erklären.
Heute wissen wir, dass diese Schlussfolgerungen richtig waren und die tetraedrisches Umgebung eines vierbindigen Kohlenstoffatoms erscheint uns selbstverständlich.
Mehr zur Natur des tetraedrischen Kohlenstoffs erfahren Sie auf der nächsten Seite. Dort finden Sie auch eine interaktive Lernapp.
Der tetraedrische Kohlenstoff
Ein Kohlenstoffatom, welches vier gleiche Reste trägt,
ist tetraedrisch koordiniert.
Ein Kohlenstoffatom, welches vier unterschiedliche Reste
trägt, ist näherungsweise tetraedrisch koordiniert -
der Tetraeder ist verzerrt.
Tetraedrischer Kohlenstoff: Ein Tetraeder ist ein regelmäßiger Körper mit vier Seiten (Tetra = vier), der von vier identischen gleichseitigen Dreiecken umschlossen ist.
In den unten gezeigten Animationen ist Methan, ein Kohlenwasserstoff, bei dem ein Kohlenstoffatom von vier Wasserstoffatomen tetraedrisch umgeben ist, gezeigt. Jeweils drei Atome bilden eine der genannten Dreiecksflächen. Mit Hilfe des Buttons "Tetraeder an" können Sie die Kanten und Flächen des Tetraeders einblenden.
Aufgabe: Drehen Sie eines oder beide Moleküle mit der Maus. Sie können die vier Wasserstoffatome farbig markieren ("Hervorhebung an"), um diese besser unterscheiden zu können.
Beobachtung: Sie können erkennen, dass alle Seiten des Tetraeders identisch sind.
Zusätzlich können ie den Stabdurchmesser und die Kugelgröße anpassen, um einen besseren Eindruck vom Molekül zu gewinnen.
|
Stabdurchmesser: Kugelgröße: |
Ein wichtiger Fokus der organischen Chemie liegt in der Herstellung neuer organischer Verbindungen. Ein Schlüsselschritt am Ende jeder Synthese ist die Isolierung der synthetisierten Substanz.
Methoden zur Isolierung werden im nächsen Kapitel beschrieben.





