Lernziele
Lernziele
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- Gemeinsamkeiten und Unterschiede der kovalenten und ionischen Bindung zu nennen und zu erläutern,
- den Begriff "Edelgaskonfiguration" und "Oktettregel" zu erläutern,
- Das Prinzip der ionischen Bindung (vollständige Elektronenübertragung) zu erklären,
- die Bildung von Anionen und Kationen aus neutralen Atomen zu beschreiben,
- das Vorzeichen und die Größe der Ladung eines Ions anhand der Stellung im Periodensystem der Elemente vorherzusagen,
- den Aufbau von Kristallgittern aus Ionen zu erklären
- die Stöchiometrie von Salzen aus der Stellung der Elemente im Periodensystem vorherzusagen,
- den Born-Haber-Kreisprozess zu beschreiben,
- das Prinzip der Bildung einer kovalenten Bindung wiederzugeben,
- die Regeln zur Darstellung von Molekülen nach Lewis anzuwenden,
- und die formale Ladung von Atomen in Molekülen zu bestimmen.
Auf der nächsten Seite findet Ihr eine Gegenüberstellung der ionischen und kovalenten Bindung.
Ionisch oder kovalent? Was ist der Unterschied?
Wie im vorhergehenden Abschnitt beschrieben wurde, ist die Ursache einer kovalenten und einer ionischen Bindung letztendlich dieselbe. Weshalb wird dennoch zwischen diesen Bindungsarten unterschieden und wie wird unterschieden?
Generell kann festgestellt werden:
- kovalente Bindungen können zwischen Atomen entstehen und führen zur Bildung von Molekülen
- ionische Bindungen können zwischen entgegengesetzt geladenen Ionen entstehen und führen zur Bildung von Salzen
Die resultierenden Stoffe unterscheiden sich stark in ihren charakteristischen Eigenschaften, was prinzipiell auf die Bindungsart bzw. die Bindungsverhältnisse zurückgeführt werden kann.
Ein großer Unterschied zwischen den Bindungsarten ergibt sich bei der Aufteilung der Elektronen zwischen den beteiligten Atomkernen bei der Bindungsbildung. Dieser Unterschied basiert auf der Strukturtheorie von Lewis, die die kovalente Bindung erklärt und der Oktetttheorie von Kossel, die die ionische Bindung erklärt. Beide Theorien beruhen auf wenigen zentralen Annahmen:
- Grundsätzlich gilt das Postulat, dass alle Atome eine Edelgaskonfiguration anstreben, also eine volle äußere Elektronenschale, da diese Konfiguration besonders stabil ist. Mit anderen Worten: Atome sind bestrebt von so vielen Elektronen umgeben zu sein, wie maximal auf die Valenzschale passen.
- Die Edelgaskonfiguration wird durch die Bildung von Bindungen erreicht.
- An der Bindungsbildung sind nur die Elektronen der Valenzschalen beteiligt.
- Atome der ersten Periode können von maximal zwei Elektronen umgeben werden, da die erste Schale lediglich zwei Elektronen aufnehmen kann (Dublett-Regel). Atome der zweiten Periode können von maximal acht Elektronen umgeben werden, da die zweite Schale acht Elektronen aufnehmen kann (Oktettregel). Für höhere Perioden gilt die Oktettregel nicht mehr streng.
-
Die ionische Bindung (Kossel)
- Die Valenzschale des einen Bindungspartners wird bis zur Vollständigkeit mit Elektronen aufgefüllt (Anion).
- Von der Valenzschale des anderen Bindungspartners werden alle Elektronen entfernt, damit die darunterliegende Schale, die vollbesetzt ist, zur Valenzschale wird (Kation).
- Kation und Anion ziehen sich aufgrund der elektrostatischen Kraft an.
-
Die kovalente Bindung (Lewis)
Die Bindungspartner bilden ein gemeinsames bindendes Elektronenpaar aus, indem sie jeder ein Elektron zu diesem Paar beisteuern. Durch das gemeinsame Nutzen dieser Elektronen erreichen sie die Edelgaskonfiguration.
Auf den nächsten Seiten ist zunächst die ionische Bindung erklärt.
Ionische Bindung I - Entstehung von Ionen 1
Wie gelingt es den, an einer ionischen Bindung beteiligten, Partnern die Edelgaskonfiguration zu erlangen und wie entsteht die Bindung?
Ionische Bindungen entstehen zwischen Atomen von Elementen mit hoher Elektronegativitätsdifferenz (typischerweise ΔEN > 1.4) und damit häufig zwischen Metallen und Nichtmetallen. Dabei gibt das weniger elektronegative Atom (siehe scheLM PSE) seine Valenzelektronen vollständig ab und wird zu einem Kation (positive Ladung). Das elektronegativere Atom nimmt so viele Elektronen auf, dass seine Valenzschale vollständig gefüllt ist und wird zu einem Anion (negative Ladung).
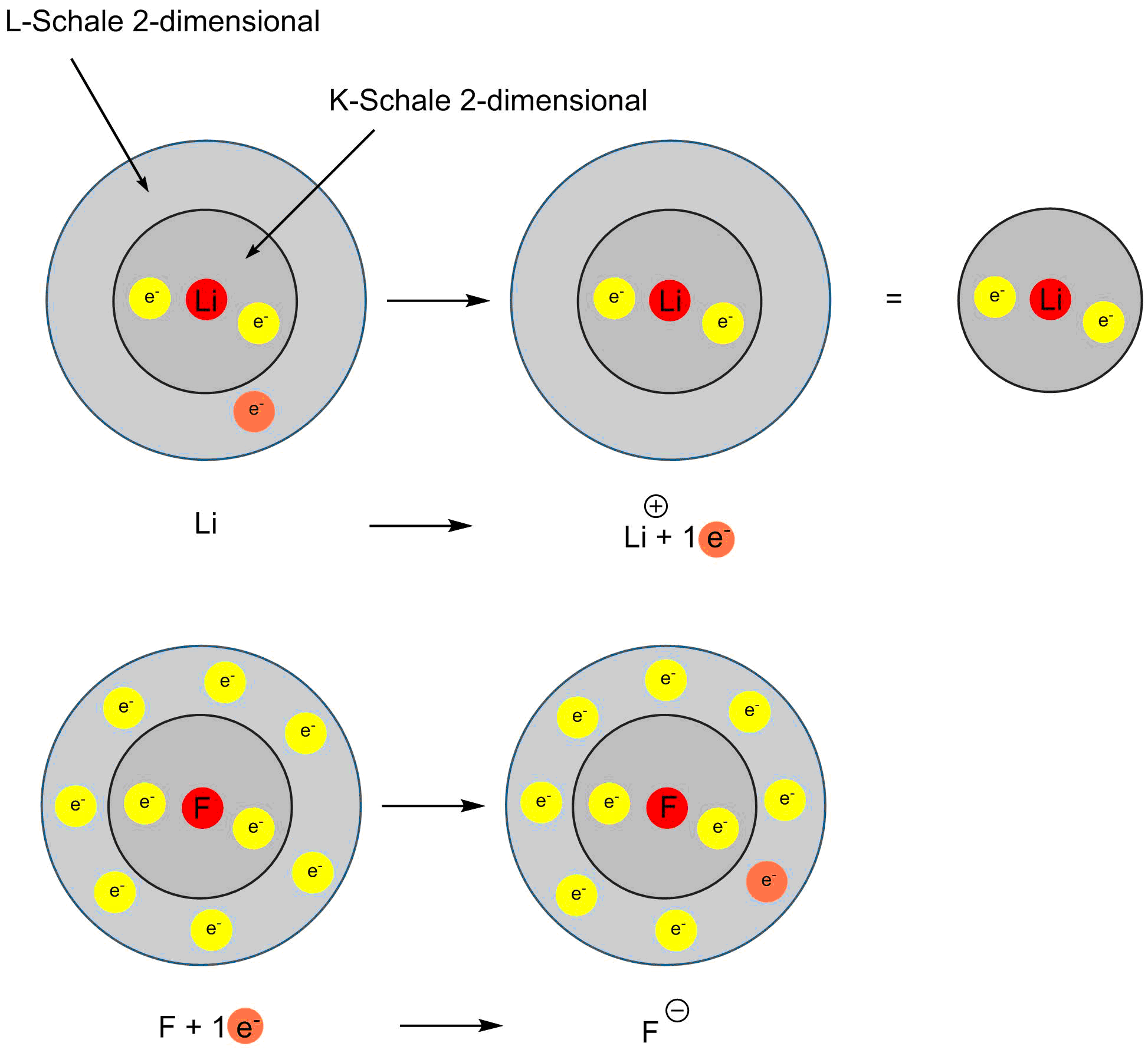
Bildung von Lithium-Kationen und Fluor-Anionen
Lithium (EN = 1.0) überträgt sein Valenzelektron vollständig auf Fluor (EN = 4.0). Dabei erhalten beide Elemente eine abgeschlossene Schale.
Elemente der ersten Hauptgruppe bilden dabei einfach positiv geladene Kationen (sie besitzen ein Valenzelektron und geben dieses ab), Elemente der siebten Hauptgruppe haben sieben Valenzelektronen und nehmen ein Elektron auf und bilden so einfach negativ geladene Anionen.
Auf der nächsten Seite findest Du ein Beispiel für die Bildung eines zweifach positiven Kations.
Ionische Bindung II - Entstehung von Ionen 2
Wir haben eben gesehen, dass Elemente der ersten Hauptgruppe einfach positive Kationen bilden, da Sie ein Valenzelektron besitzen. Analog bilden Elemente der zweiten Hauptgruppe zweifach positive Kationen.
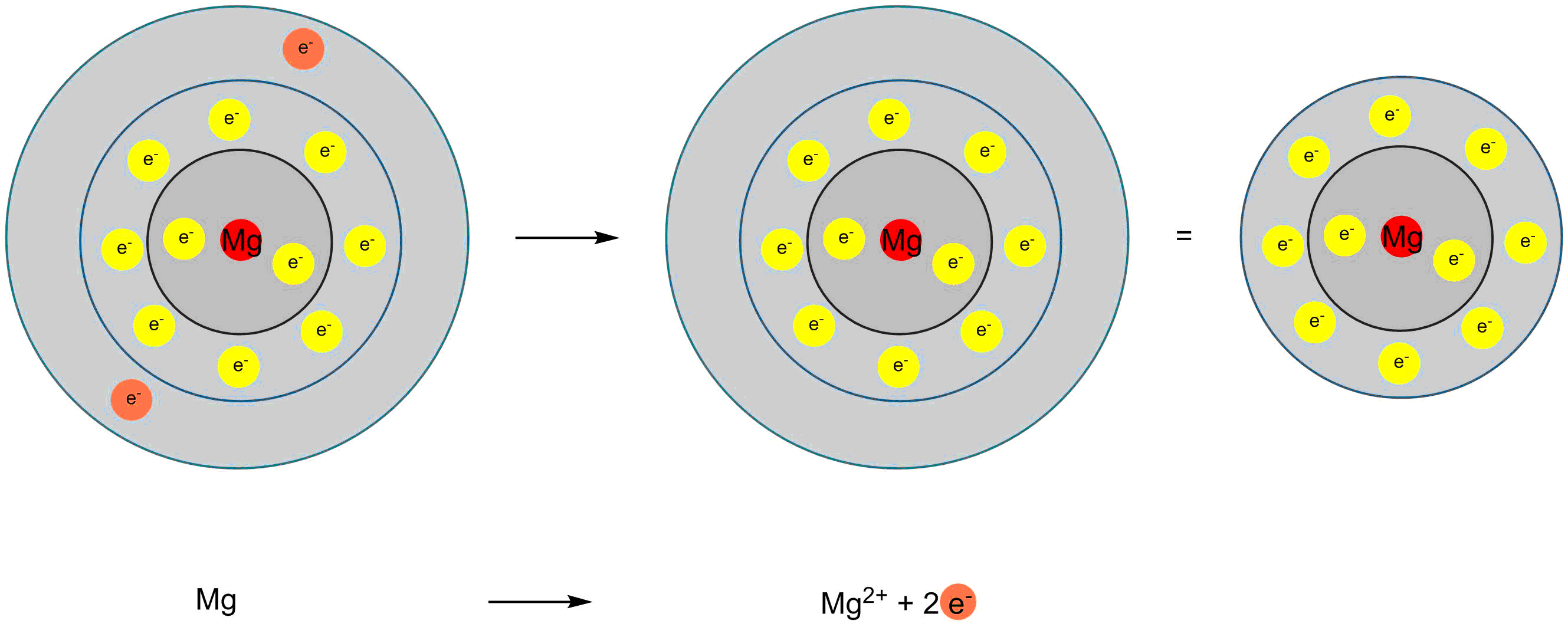
Bildung von Magnesium-Kationen
Dies ist hier am Beispiel des Magnesiums gezeigt. Es hat zwei Valenzelktronen. Durch Abgabe beider Valenzelektronen erhält man ein zweifach positiv geladenes Kation mit einer abgeschlossenen Valenzschale.
Auf der nächsten Seite sind weitere Beispiele für die Bildung von Ionen gezeigt.
Ionische Bindung III - Entstehung von Ionen 3
Auf Seite 3 haben wir gesehen, dass Fluor einfach negativ geladene Anionen bildet. Das höhere Gruppenhomologe Chlor verhält sich wie Fluor und bildet einfach negative Anionen.
Sauerstoff hingegen steht in der sechsten Hauptgruppe. Es muss zwei Elektronen aufnehmen, um eine abgeschlossene Schale zu erhalten. Es bildet daher zweifach negativ geladene Anionen.
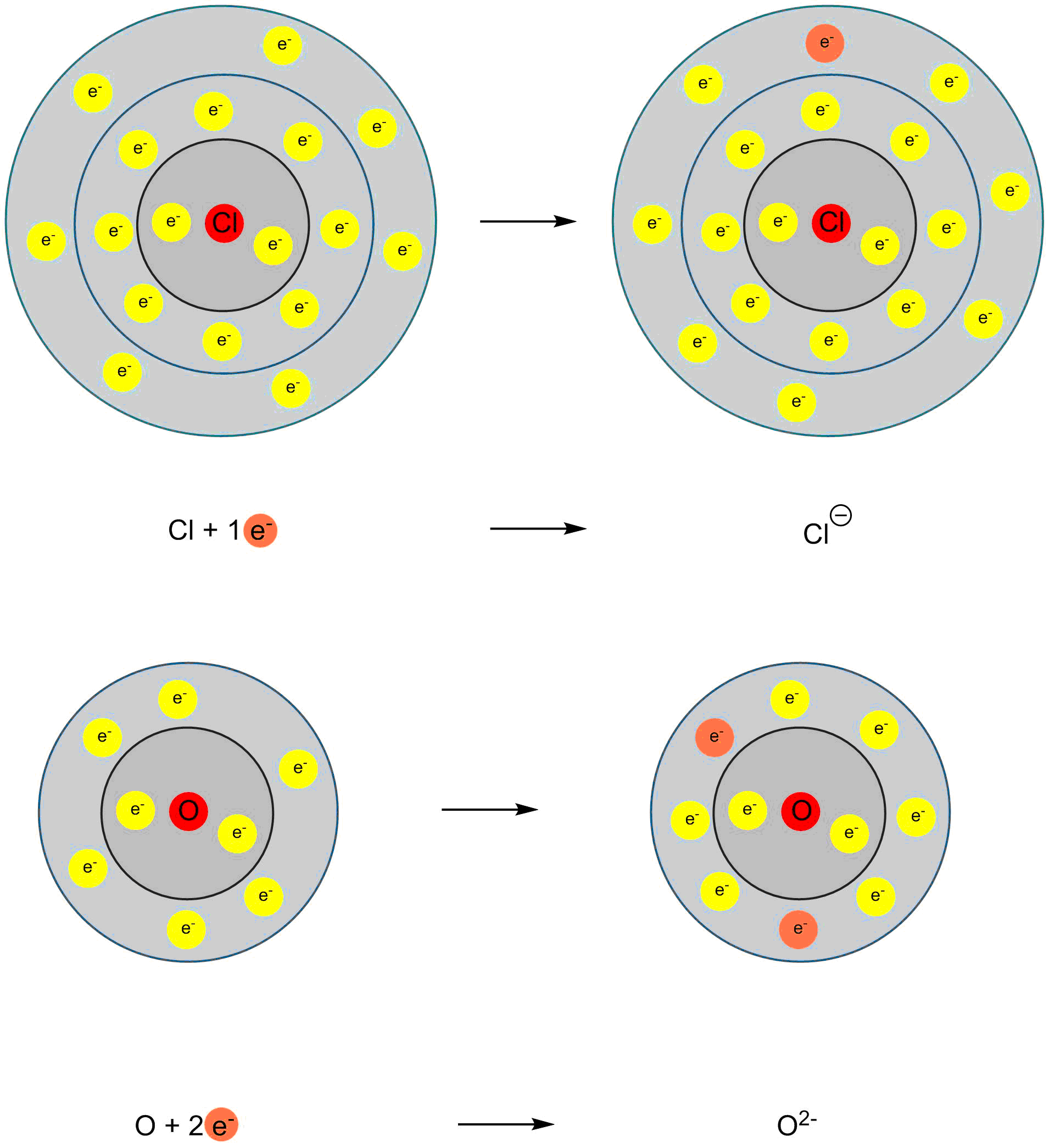
Bildung von Chlor- und Sauerstoff-Anionen
So bilden Metalle (links im Persiodensystem) Kationen und Nichtmetalle (rechts im Periodensystem) Anionen. Die Ladung der Ionen kann aus der Position im Periodensystem abgeleitet werden.
Auf den nächsten Seiten wird der Aufbau eines Kristallgitters aus den Ionen beschrieben.
Ionische Bindung IV - Kristallgitter 1
Beide ehemaligen Atome sind nun zu Ionen geworden, die eine vollbesetzte Valenzschale besitzen. Diese entgegengesetzt geladenen „Atomionen“ ziehen sich nach dem Gesetz von Coulomb an. Die Ionen werden als kugelsymmetrische Ladungen aufgefasst, die einen optimalen Abstand zueinander einnehmen, sodass Epot minimal (also maximal negativ) wird. Da die Coulombkraft ungerichtet, d.h. in alle Raumrichtungen gleich groß, ist, zieht ein Ion entgegengesetzt geladene Ionen aus allen Richtungen gleich stark an, wodurch im Normalfall nicht nur ein Ionenpaar resultiert, sondern ein Ionengitter entsteht, in dem eine Vielzahl von einzelnen Ionenbindungen vorliegt. Das Ergebnis ist ein Salzkristall, also ein Feststoff. Ideale Kristalle sind dreidimensional unendliche Anordnungen von Gitteerbausteinen.
Tatsächlich liegen Ionenpaare nur in der Gasphase vor.
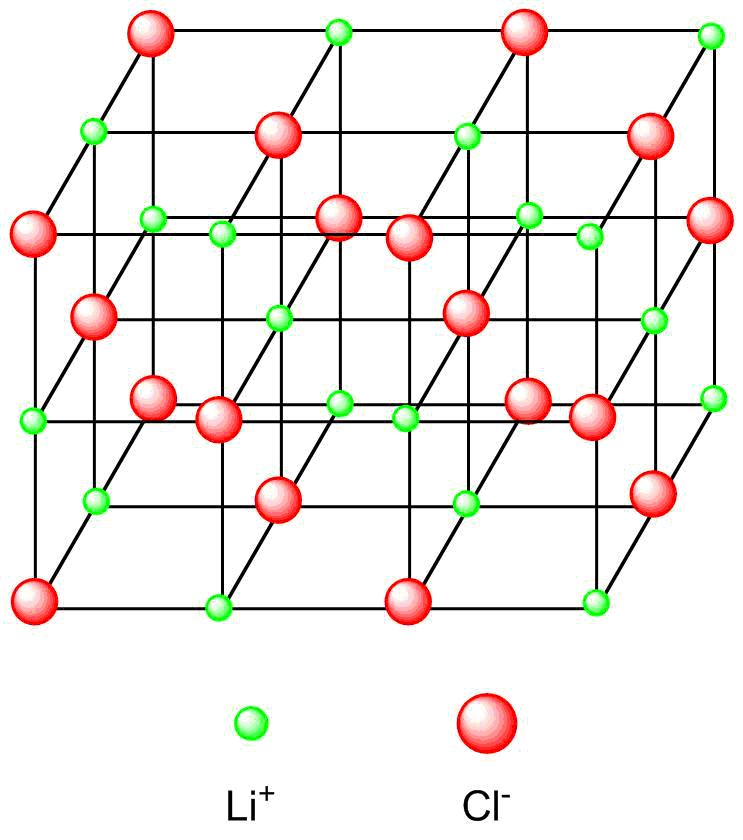
Kristallgitter von Lithiumfluorid
Auf der nächsten Seite ist der gleiche Inhalt noch einmal in einer interaktiven App wiederholt.
Ionische Bindung V - Kristallgitter 2
Im folgenden ist die NaCl-Struktur gezeigt, die der LiCl Struktur entspricht. Hier handelt es sich aber nicht um ein Bild, sondern um eine JsMol-App. Ihr könnt die Struktur drehen (Auge-Hand-Koordnation) und mit den Buttons unter der abbildung manipulieren.
Es ist 1 Elementarzelle gezeigt, die Darstellung erlaubt aber auch 2*2*2 oder 3*3*3 Elementarzellen. Auch Schnitte durch die struktur können angezeigt werden, es besteht die Möglichkeit, die Ionen maßstäblich in die Struktur einzublenden (Ionenradius). Ihr könnt Euch auch den "Koordinationsoktaeder" um jedes Ion anzeigen lassen, oder eine "Elementarzelle".
Aufgabe: Dreht die Strukzur mit der Maus und testet verschiedene Einstellungen, um einen Eindruck von der dreidimensionalen Struktur zu erhalten.
Bitte Warten
Das Laden der Strukturdaten dauert einen Augenblick. Bitte haben Sie etwas Geduld!
0 von 0 Strukturen wurden bereits geladen.
|
Auf der nächsten Seite werden die Konsequenzen für die Stöchiometrie der erhaltenen Salze und der Born-Haber-Kreisprozess diskutiert.
Ionische Bindung VI - Stöchiometrie
Die Stöchiometrie der Ionenverbindung ergibt sich aus der Anzahl der abgegebenen und aufgenommenen Elektronen.
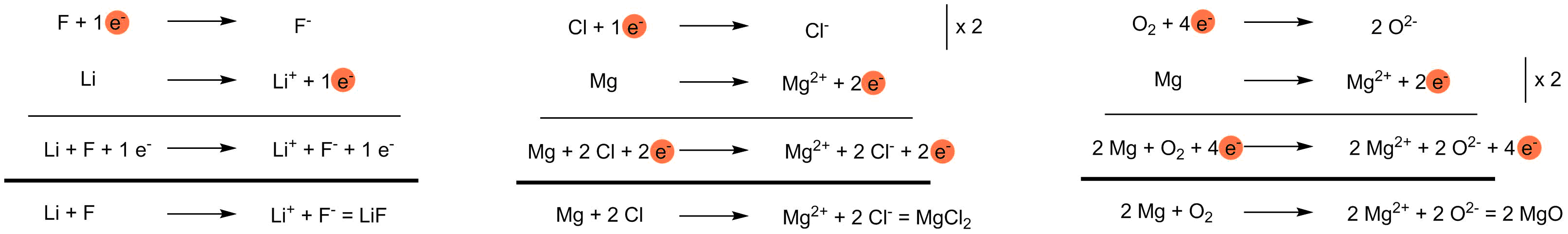
Ermittlung der Stöchiometrie
Im Zusammenhang der Bildung von Ionenverbindungen treten häufig die Begriffe Ionisierungsenergie und Elektronenaffinität auf. Die Ionisierungsenergie ist die Energie die benötigt wird, um das zum betrachteten Zeitpunkt äußerste Elektron eines Atoms oder Kations, welches sich in der Gasphase befindet, zu entfernen. Sie ist also ein Maß dafür, wie stark der Atomkern ein vorhandenes Elektron bindet. Die Elektronenaffinität ist die Energie, die umgesetzt wird, wenn ein sich in der Gasphase befindliches Atom oder Anion ein weiteres Elektron aufnimmt. Sie ist also ein Maß dafür wie stark der Atomkern ein weiteres Elektron binden kann.
Bei der energetischen Betrachtung der Ionenpaarbindung mithilfe des Born-Haber-Kreisprozesses wird deutlich, dass die Summe aus Ionisierungsenergie und Elektronenaffinität oft positiv ist. Demzufolge ist die Erreichung der Edelgaskonfiguration für das System energetisch ungünstig. Erst die Coulomb Wechselwirkung und die daraus resultierenden Bindungen bzw. die Gitterbildung sorgt für den notwendigen Energiebeitrag. Dies soll hier am Beispiel des NaCl gezeigt werden:
Die Standardbildungsenthalpie von NaCl beträgt:

Laut dem Satz von Hess ist die Reaktionsenthalpie unabhängig vom Reaktionsweg. Kann eine Reaktion als Summe von Teilreaktionen aufgefasst werden, so ist ihre Reaktionsenthalpie gleich der Summe der Reaktionsenthalpien der Teilreaktionen. Die Teilreaktionen ergeben sich aus dem Born-Haber-Kreisprozess.
Verdampfen des Natriums zu Na-Atomen (Sublimationsenergie):

Dissoziation des gasförmigen Cl2 in Cl-Atome (1/2 Dissoziationsenergie):
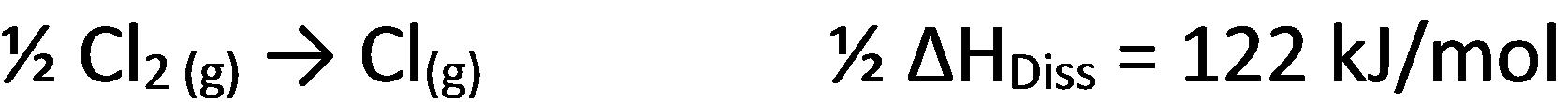
Ionisierung der Na-Atome zu Natriumionen (Ionisierungsenergie):

Aufnahme eines Elektrons durch ein Chloratom (Elektronenaffinität):

Bildung des Gitters (Gitterenergie):
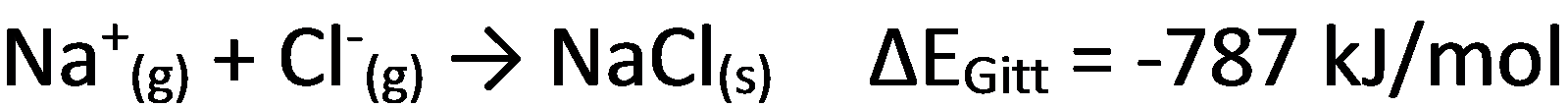
Es wird deutlich, dass die Summe aus Ionisierungsenergie und Elektronenaffinität 496 kJ/mol - 349 kJ/mol = 147 kJ/mol größer als 0 ist und damit die Erreichung der Edelgaskonfiguration für das System NaCl zunächst energetisch ungünstig ist. Erst die Gitterenergie, die aus der Bildung ionischer Bindungen resultiert macht die Ionisierung der Atome attraktiv.
Nach der ionischen Bindung wird nun auf den nächsten Seiten die kovalente Bindung behandelt.
Kovalente Bindung I (Wasserstoff)
Die Bildung hochgeladener Ionen erfordert sehr viel Energie.* Dies führt dazu, dass
sich sehr hoch geladene Ionen (höher als 3+ oder 2-) eher selten bilden. Daher werden
ionische Bindungen zwischen hoch geladenen Ionen nicht beobachtet (B3+,
C4+, N3-, ...).
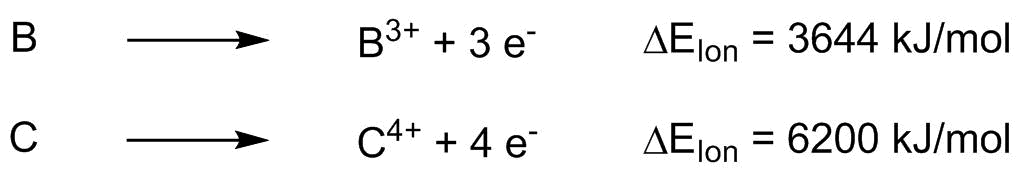
Ionisierungsenergien von Bor und Kohlenstoff
Daher wird hier ein anderer Weg der Bindungsbildung gewählt. Die entsprechenden Atome kombinieren ihre Valenzelektronen miteinander. Dies kann als ein gemeinsames Teilen von Elektronen oder als Ausbildung einer gemeinsamen Valenzschale interpretiert werden, wodurch es den Atomen gelingt von einer günstigen Anzahl an Elektronen umgeben zu sein.
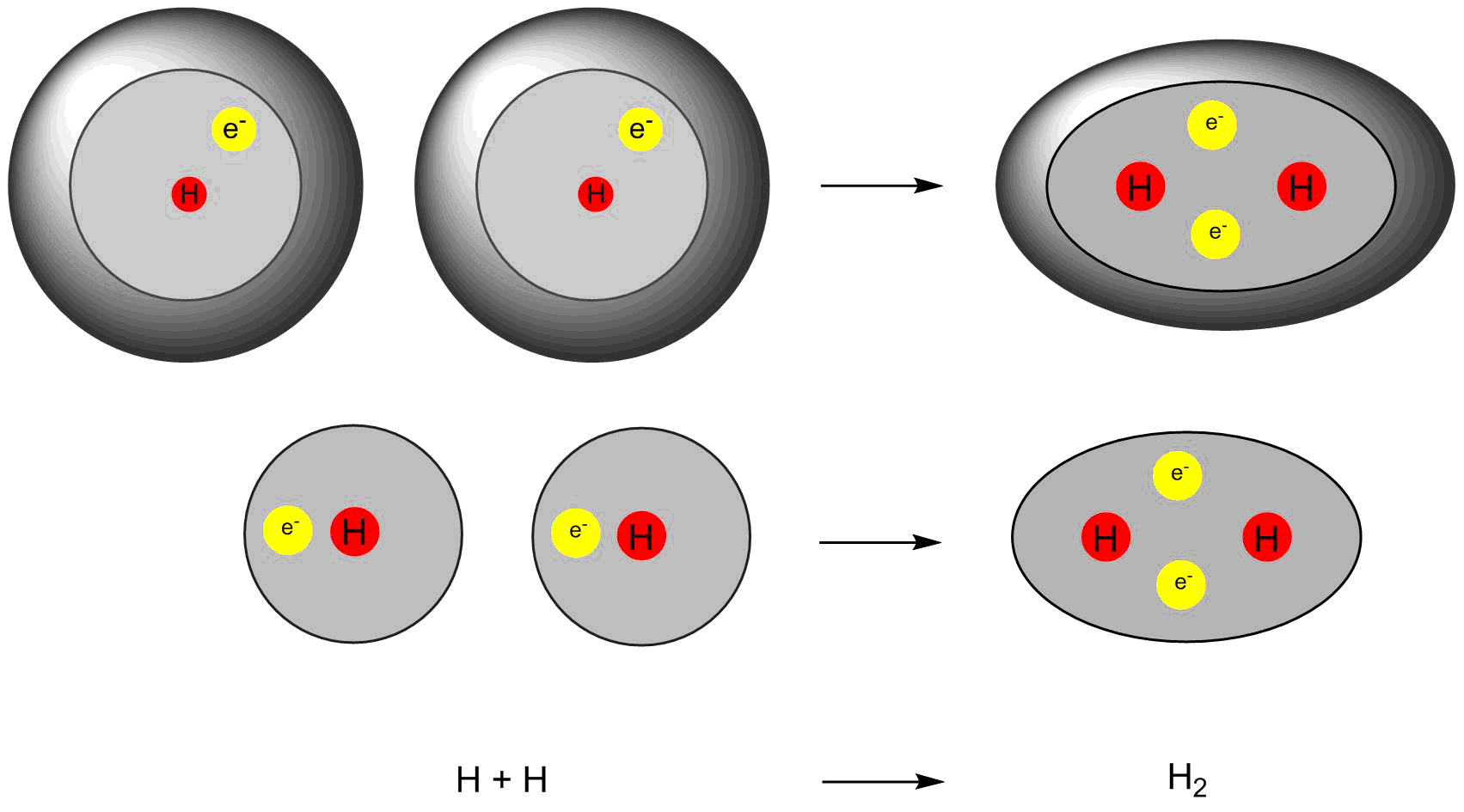
Bildung eines Wasserstoffmoleküls aus zwei Wasserstoffatomen
Das Wasserstoffatom hat ein Valenzelektron. Um die Edelgaskonfiguration zu erreichen benötigt es ein weiteres Elektron. Dies erhält es von einem weiteren Wasserstoffatom, indem es eine kovalente Bindung mit ihm eingeht. Beide Atome stellen dafür jeweils ein Elektron zur Verfügung und ermöglichen es so sich und dem Bindungspartner von zwei Elektronen umgeben zu sein und gewissermaßen eine gefüllte Valenzschale zu erreichen. Der alternative Weg über eine Ionisierung und anschließende Ionenbindung wäre energetisch sehr ungünstig, was der Vergleich der Ionisierungsenergie (13.6 eV pro Atom) und Elektronenaffinität (0.75 eV pro Atom) von Wasserstoff verdeutlicht.
Immer ein Paar von Elektronen bildet eine Bindung. Daher spricht man auch von der Elektronenpaarbindung.
In ganz analoger Weise erfolgt auch die Bindungsbindung in anderen homonuklearen Molekülen wie O2, F2, Cl2 usw. Wenn man sich hier ionische Bindungen vorstellt, dann müßte es im Sauerstoff 3 O2--Ionen und ein O6+-Ion geben, damit alle Atome Edelgaskonfiguration erreichen, bei den Halogenen bräuchte man auf 7 F--/Cl--Ionen und 1 F7+-/Cl7+-Ion. So hohe Ladungen sind nicht möglich und daher ist eine ionische Bindung hier undenkbar.
* Bei der Bildung der Kationen sind die hohen Ionisierungsenergien das Problem, bei der Bildung von Anionendie hohen Elektronenaffinitäten
Nach dem einfachsten Molekül, dem Wasserstoffmolekül wird auf der nächsten Seite das Methanmolekül (CH4) behandelt.
Kovalente Bindung II (Methan)
Wie die Bildung des Wasserstoffmoleküls funktioniert auch die Bildung des Methans. Jedes der vier Wasserstoffatome benötigt ein weiteres Elektron für eine gefüllte Valenzschale. Das Kohlenstoffatom benötigt vier Elektronen um seine Valenzschale zu füllen. Es stellt also jedem Wasserstoffatom eines seiner vier Elektronen zur Verfügung. Im Gegenzug stellt jedes der vier Wasserstoffatome dem Kohlenstoffatom ein Elektron zur Verfügung. Es werden vier kovalente Bindungen gebildet. Damit ist gewährleistet, dass jedes Wasserstoffatom von zwei Valenzelektronen und jedes Kohlenstoffatom von acht Valenzelektronen umgeben ist.
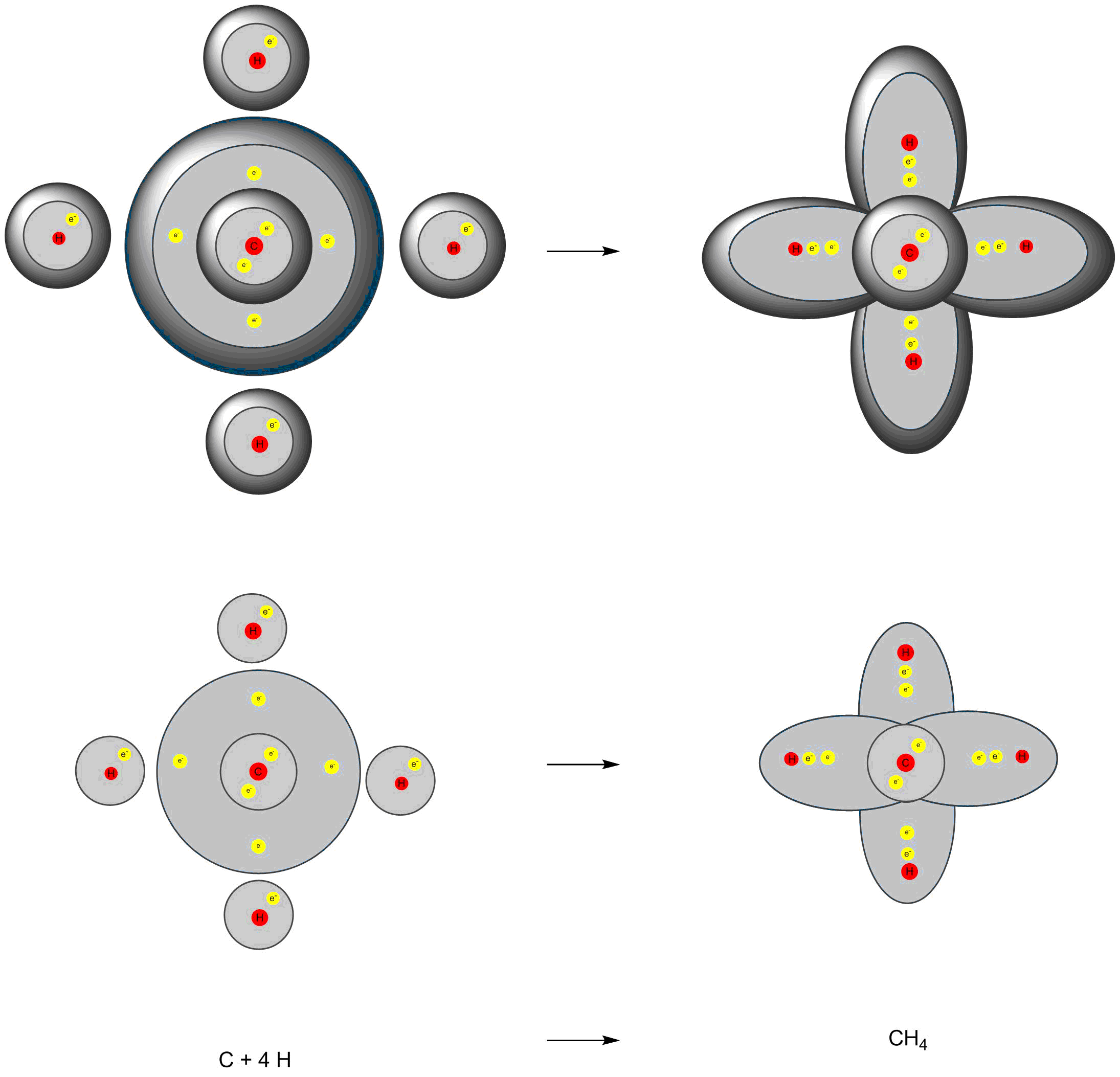
Bildung eines Methanmoleküls
Die Elektronen einer kovalenten Bindung (Elektronenpaarbindung) werden den beiden Atomen zugerechnet,
die sie verbinden.
So erreichten die vier Wasserstoffatome zwei Außenelektronen (Dublett-Regel),
Kohlenstoff hat acht Außenelektronen und erfüllt die Oktettregel.
Zur Beschreibung der elektronischen Verhältnisse in diesen Systemen hat Lewis eine Schreibweise für chemische Strukturen entwickelt, die heute als Lewis-Strukturen bezeichnet werden. Dies ist auf der nächsten Seite gezeigt.
Lewis-Strukturen
Um die Bindungen zwischen Atomen eines Moleküls formal darzustellen entwickelte Lewis die sogenannten Lewis-Formeln oder Lewis-Strukturen, die auch als Elektronenformeln bezeichnet werden. Dabei werden die Valenzelektronen eines Atoms als Punkte um das Elementsymbol des Atoms gezeichnet.
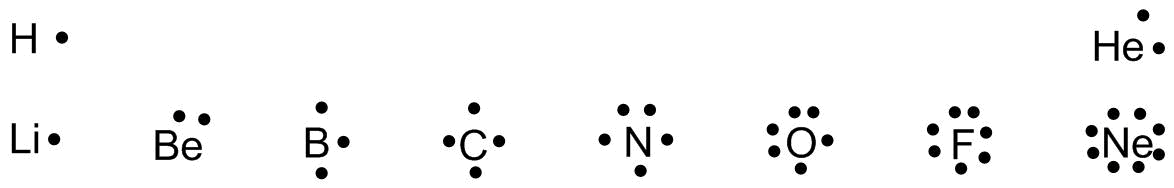
Lewis-Formeln einiger Atome
Um eine kovalente Bindung darzustellen werden die aneinander gebundenen Atome nebeneinander geschrieben und die Elektronen, die sich die Atome teilen, zwischen diese Atome. Die restlichen Valenzelektronen eines Atoms werden paarweise auf die restlichen Seiten des Atoms verteilt. Dabei ist zu beachten, dass jedes Atom von insgesamt 8 (gilt streng für die zweite Periode, Oktettregel) bzw. 2 (gilt streng für die erste Periode, Dublettregel) Elektronen umgeben ist.
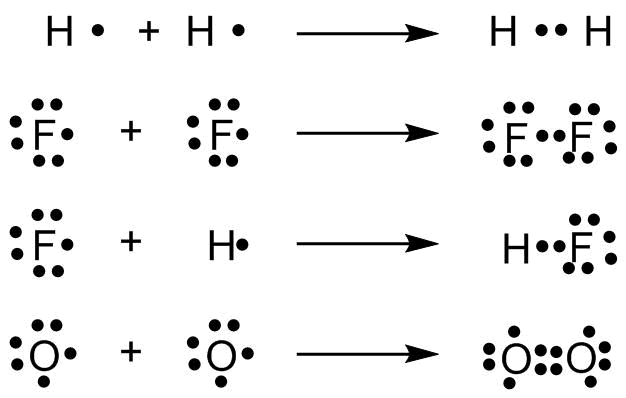
Lewis-Srukturen einiger Verbindungen
ZUr Übersichtlichkeit werden Elektronenpaare in der Regel zu einen Strich zusammengefaßt, d.h. aus zwei Punkten wird ein Strich. Dabei werden die Elektronenpaare, die sich zwei Atome miteinander teilen, als Strich von einem Atom zum anderen eingezeichnet. Die nichtbindenden Elektronen werden als Strich am betreffenden Atom eingezeichnet. Die resultierenden Formeln werden als Valenzstrichformeln bezeichnet, da die Valenzelektronen als Striche dargestellt werden. Im täglichen Gebrauch wird nicht streng zwischen Valenzstrichformeln und Elektronenformeln unterschieden. Es sind Mischformen üblich, die in Orbitalen gepaarte Elektronen als Strich und ungepaarte Elektronen als Punkt darstellen.
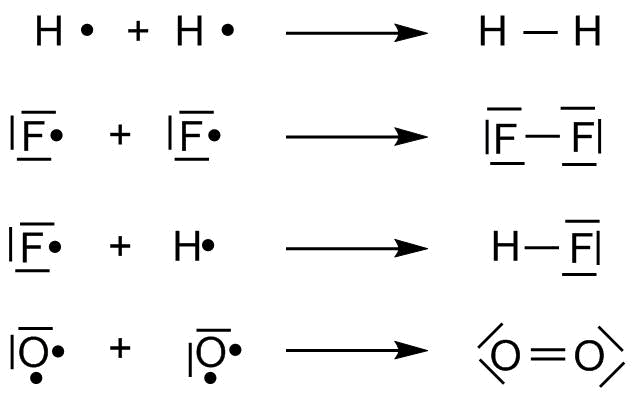
Valenzstrichformeln einiger Verbindungen
Gibt es ein bindendes Elektronenpaar zwischen zwei Atomen spricht man von einer Einfachbindung, gibt es zwei bindende Elektronenpare von einer Doppelbindung (siehe Sauerstoff).
Bei den sogenannten Skelettformeln (hier nicht abgebildet) werden nichtbindende Elektronenpaare nicht mitgeschrieben. Mithilfe dieser Formeln ist es möglich einen ersten Überblick über die Bindungsverhältnisse und die Elektronenkonfiguration eines Moleküls zu erhalten. Im weiteren Verlauf dieses eLearning-Moduls wird die Mischform von Elektronen-, Valenzstrich- und Skelettstruktur synonym mit Lewis-Formel bzw. Lewis-Struktur verwendet.
Bei der Erstellung von Lewis-Strukturen können "formale Ladungen" auftreten. Dies ist auf der nächsten Seite gezeigt.
Formalladung I
Die Lewis-Schreibweise ermöglicht es festzustellen, ob die Atome eines Moleküls elektrisch geladen sind, also ob sie von mehr oder weniger Elektronen umgeben sind, als sie Protonen im Kern aufweisen (Formalladung). Zur Ermittlung dieser Formalladung wird das Molekül in der Lewisformel aufgezeichnet. Dann werden den einzelnen Atomen die vorhandenen Elektronen zugeordnet. Bei dieser Zuordnung wird wie folgt vorgegangen:
- Alle Elektronen eines Atoms, die an keiner Bindung beteiligt sind werden diesem Atom zugeordnet.
- Alle an Bindungen des Atoms beteiligten Elektronen werden diesem zur Hälfte zugeordnet. Dies entspricht einer homolytischen Bindungsspaltung. Liegt also eine Einfachbindung zwischen zwei Atomen vor wird demnach ein Bindungselektron dieser Bindung dem ersten, das andere dem zweiten Atom zugeordnet.
- Nun wird die Summe der einem Atom im Molekül zugeordneten Elektronen mit der Summe seiner Valenzelektronen im atomaren Zustand verglichen. Sind die Summen ungleich, erhält es eine Formalladung. Diese ist positiv, falls es weniger und negativ, falls es mehr Elektronen als im atomaren Zustand aufweist. Der Wert der Formalladung entspricht der Elektronendifferenz. Alternativ kann auch die Zahl der Valenzelektronen mit der Hauptgruppennummer verglichen werden oder die Anzahl an Kernprotonen mit der Anzahl an Elektronen.
Diese Regeln mögen auf den ersten Blick verwirrend sein, aber schauen wir uns dies an einem Beipiel an.
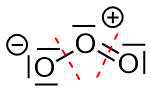
Ozon
-
Das linke Sauerstoffatom
- Das Atom besitzt 3 nichtbindende Elektronenpaare. Dies ergibt 6 Elektronen.
- Das Atom besitzt 1 bindendes Elektronenpaar. Dieses zählt zur Hälfte zu diesem Atom. 1 Elektron kommt hinzu. Zusammen mit den 6 Elektronen von a) macht das 7 Elektronen auf der Valenzschale.
- Sauerstoff steht in der 6. Hauptgruppe. Es sollte also 6 Valenzelektronen haben.
- Daraus ergibt sich eine Ladung von 6 (Valenelektronen im neutralen Atom) - 7 (tatsächlich vorhandenen Valenelektronen) = -1.
- Dies wird durch das Minuszeichen im Kreis symbolisiert.
-
Das mittlere Sauerstoffatom
- Das Atom besitzt 1 nichtbindendes Elektronenpaar. Dies ergibt 2 Elektronen.
- Das Atom besitzt 3 bindende Elektronenpaare. Diese zählen zur Hälfte zu diesem Atom. 3 Elektronen kommen hinzu. Zusammen mit den 2 Elektronen von a) macht das 5 Elektronen auf der Valenzschale.
- Sauerstoff steht in der 6. Hauptgruppe. Es sollte also 6 Valenzelektronen haben.
- Daraus ergibt sich eine Ladung von 6 (Valenelektronen im neutralen Atom) - 5 (tatsächlich vorhandenen Valenelektronen) = 1.
- Dies wird durch das Pluszeichen im Kreis symbolisiert.
-
Das rechte Sauerstoffatom
- Das Atom besitzt 2 nichtbindende Elektronenpaare. Dies ergibt 4 Elektronen.
- Das Atom besitzt 2 bindende Elektronenpaare. Diese zählen zur Hälfte zu diesem Atom. 2 Elektronen kommen hinzu. Zusammen mit den 4 Elektronen von a) macht das 6 Elektronen auf der Valenzschale.
- Sauerstoff steht in der 6. Hauptgruppe. Es sollte also 6 Valenzelektronen haben.
- Daraus ergibt sich eine Ladung von 6 (Valenelektronen im neutralen Atom) - 6 (tatsächlich vorhandenen Valenelektronen) = 0.
- Dieses Atom hat keine Formalladung.
Auf der nächsten Seite sind noch einige Beispiele gezeigt.
Formalladung II
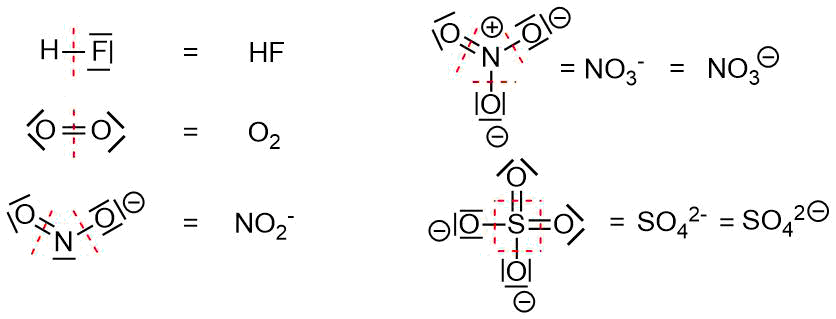
Ermittlung der Formalladung
Beim Schreiben von Formeln gilt dabei:
- Die Ladung kann an jedes einzelne Atom (formale Ladung), oder an das Gesamtmolekül (Gesamtladung) geschrieben werden.
- Das Vorzeichen der Ladung wird duch ein Plus- oder Minuszeichen symbolisiert, welches häufig (aber nicht immer in einen Kreis gesetzt ist) markiert. (Mit chemischen Zeichenprogrammen, wie ChemOffice ist es leicht möglich ein Plus- oder Minuszeichen im Kreis an eine Struktur zu schreiben, im Fließtext ist das aber schwieriger, weil die entsprechenden Zeichen in Zeichensätzen in der Regel fehlen.)
- Ist der Betrag der formalen Ladung dem betrag nach größer als 1, so schreibt man x2+, x3+, x4+, ... Bzw. x2-, x3-, x4-, ...
Die Summe der formalen Ladungen aller Atome im Molekül gibt die Gesamtladung des Moleküls.
Es gibt verschiedene Verfahren, Elektronen zu zählen. Je nach Methode erhält man Informationen zur Oktettregel oder die formale Ladung. Näheres erfahrt Ihr auf der nächsten Seite.
Oktettregel und formale Ladung
In den letzten Kapiteln haben wir die Begriffe Oktettregel und formale Ladung kennengelernt. Diese beiden Begriffe sollen hier noch einmal gegenübergestellt werden.
| 1. Oktettregel | |
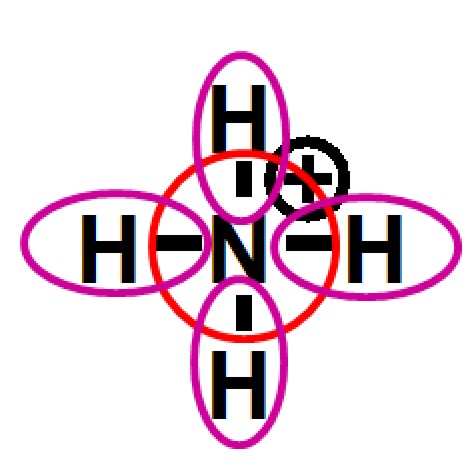
|
|
| 2. formale Ladung | |
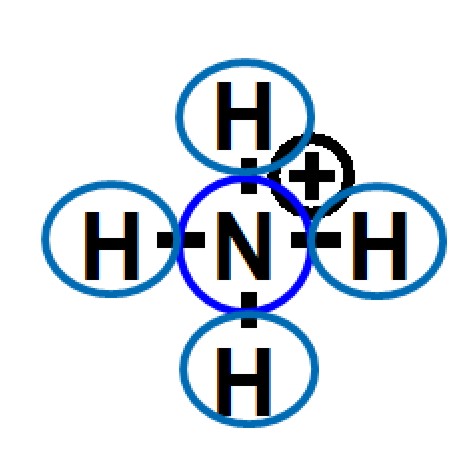
|
|
Bei der Bestimmung der Valenzelektronen im Bezug auf die Oktettregel und bei
der Bestimmung der formalen Ladung
werden Elektronen gezählt. Dabei werden aber verschiedene
Vorschriften amgerwendet.
Die beiden Zählweisen sind wichtig um Moleküle
hinsichtlich ihrer chemischen Eigenschaften zu klassifizieren und
beide müssen gut auseinandergehalten werden.
Auf der nächsten Seite findet Ihr den Abschlusstest.
Abschlusstest
scheLM Multiple Choice
Im folgenden gibt es einen Muliple-Choice-Tests mit 15 Fragen zu Lewis Strukturen.
Die Tests können mehrfach bearbeitet weden. Die Fragen verändern sich. Zur Bearbeitung des Tests müsst Ihr Euch anmelden.
Das nächste Kapitel befasst sich mit der Elektronegativität.