Lernziele
Lernziele
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- zu erklären, warum es keine 1,2-Dichlorbenzol-derivate gibt,
- ein Energiediagramm für zwei mesomere Grenzstrukturen und die tatsächliche Struktur zu zeichnen
- den Begriff delokalisierte Elektronen definieren,
- Mesomere grenzstrukturen für einfache Moleküle zu schreiben,
- die Regeln zum Schreiben mesomerer Grenzstrukturen wiederzugeben und anzuwende und
- die Bedeutung der mesomeren Grenzstrukturen für die chemische Reaktivität zu erläutern.
Auf der nächsten Seite findet Ihr eine Einführung zum Thema Resonanzstrukturen.
Einleitung
Für 1,2-Dichlorbenzol können formal zwei Strukturen geschrieben werden. Bei der einen gibt es eine Einfachbindung zwischen den beiden Kohlenstofatomen, die die Chloratome tragen, bei der anderen gibt es an der gleichen Stelle eine Doppelbindung.
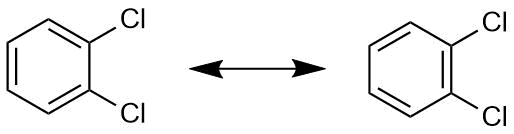
Mesomere Grenzstrukturen von 1,2-Dichlorbenzol
Man könnte also erwarten, das zwei verschiedene Isomere von
1,2-Dichlorbenzol existieren. Dies ist aber nicht der Fall.
Man beobachtet nur eine Struktur.
Wie kann man dies erklären? Dies soll zunächst am noch
einfacheren Beispiel Benzol gezeigt werden.
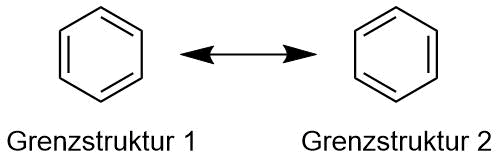
Mesomere Grenzstrukturen von Benzol
Hier existieren zwei identische Strukturen, aber an der Situation ändert
sich nichts. Es existieren formal zwei Strukturen. Welche ist die richtige?
Die Antwort mag überraschen: Keine von beiden. Dies ist in der
Abbildung unten gezeigt. Man kann zwei mesomere Grenzstrukturen schreiben,
die Wahrheit liegt aber irgendwo dazwischen. Sie ist energetisch
günstiger als die hypothetischen Grenzstrukturen.
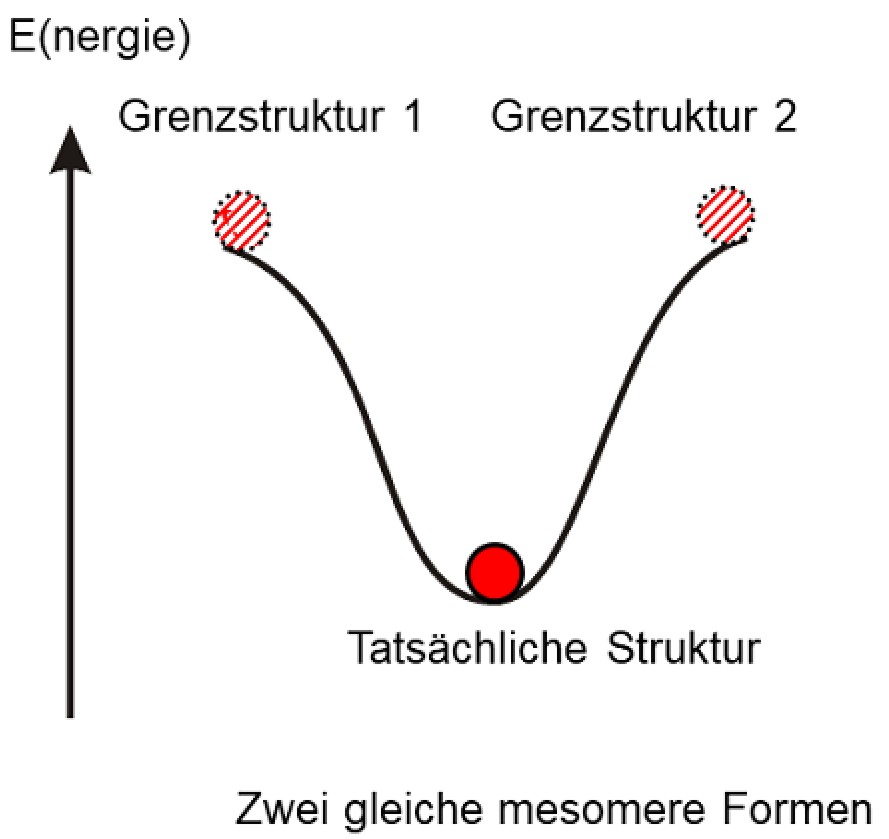
Mesomerie
Auch wenn mesomere Grenzstrukturen nicht existieren und die Wahrheit zwischen den gezeigten Grenzstrukturen liegt, so ist das Schreiben von Grenzstrukturen notwendig zur Beschreibung der chemischen Eigenschaften einer Verbindung.
Eine vereinfachte Schreibweise für mesomere Grenzstrukturen wird auf der nächsten Seite eingeführt.
Benzol
Wie gesagt gibt keine der beiden unten gezeigten Strukturen die realen Bindungsverhältnisse wieder. Die Wahrheit liegt zwischen den beiden Darstellungen. Alle Bindungen haben die gleiche Länge. Es gibt keine alternierenden Doppel- und Einfachbindungen. Dieser Sachverhalt kann durch klassische Lewisstrukturen nur durch Angabe der beiden Grenzstrukturen gezeigt werden.

Mesomere Grenzstrukturen von Benzol
Mesomere Grenzstrukturen werden immer durch den gezeigten Doppelpfeil markiert. Man darf hier keine anderen Pfeile verwenden und der Mesomeriepfeil darf nirgendwo sonst verwendet werden.
Da es lästig ist, immer zwei (oder in anderen Fällen auch mehr) Grenzstrukturen zu schreiben, hat man sich bemüht, eine einfache Schreibweise zu entwickeln.
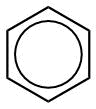
Benzol mit delokalisierten Elektronen
Die Elektronenpaare der Doppelbindungen sind nicht mehr lokalisiert. Solche Elektronenpaare werden als delokalisiert bezeichnet.
Betrachtet man die beiden Strukturen oben, so gelangt man von einer Struktur zur nächsten, in dem man die Doppelbindungen umklappt oder verschiebt. Dies ist auf der nächsten Seite noch einmal in zwei Animationen gezeigt.
Verschieben und Umklappen von Elektronen: Benzol
Man gelangt von einer mesomeren Grenzstruktur zur anderen, durch umklappen oder verschieben von Elektronenpaaren.
Aufgabe: Betrachte die beiden Filme und lies die darunterstehenden Kommentare!
| Umklappen von Elektronenpaaren. | Verschieben von Elektronenpaaren |
|
|
|
|
|
Das Umklappen und das Verschieben von Elektronenpaaren liefert das gleiche Ergebnis
Auf der nächsten Seite ist ein zweites Beispiel (ein Carboxylat) gezeigt.
Verschieben und Umklappen von Elektronenpaaren: Carboxylat
Mesomere Grenzstrukturen spielen nicht nur im Benzol eine Rolle, auch beim Carboxylat-Ion können mesomere Grenzstrukturen geschrieben werden.
Aufgabe: Betrachte die beiden Filme und lies die darunterstehenden Kommentare!
| Umklappen von Elektronenpaaren. | Verschieben von Elektronenpaaren |
|
|
|
|
|
Häufig ist das Verschieben von Elektronen mit dem Verschieben von Ladungen gekoppelt.
Auf der nächsten Seite erfahrt Ihr, wie Grenzstrukturen aufgestellt werden.
Resonanzformeln I
Wie im vorherigen Kapitel gezeigt wurde können chemische Bindungen einen kovalenten und einen ionischen Bindungsanteil, Partialladungen und ein Dipolmoment aufweisen.
Um diese Eigenschaften und die Bindungsverhältnisse eines Moleküls besser zu visualisieren werden Resonanzstrukturen genutzt. Dabei werden die Begriffe Resonanzstruktur, Grenzstruktur und mesomere Struktur synonym verwendet.
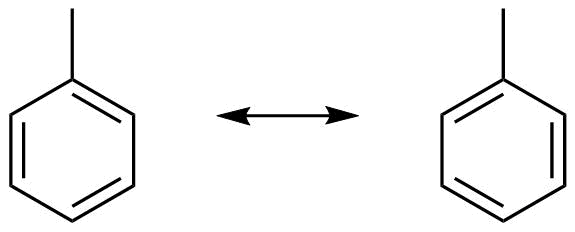
Resonanzformeln des Toluols
Zum Aufstellen der Resonanzstrukturen eines Moleküls wird zunächst dessen Lewis-Struktur aufgezeichnet. Diese Lewis-Struktur ist zugleich die erste Resonanzstruktur. Weitere Resonanzstrukturen werden nun durch Verschieben von Elektronenpaaren innerhalb des Moleküls erhalten. Die Kernpositionen bleiben dabei konstant und werden nicht verändert, d.h. die Molekülgeometrie bleibt gleich. Damit entsprechen die Grenzstrukturen möglichen, extremen Elektronenverteilungen im Molekül bei gleicher Molekülgeometrie. Keine Grenzstruktur beschreibt die tatsächliche Bindungssituation vollständig korrekt, daher der Begriff Grenzstruktur. Die tatsächliche Bindungssituation liegt zwischen den Resonanzstrukturen und darf in Näherung als Überlagerung sämtlicher Grenzstrukturen aufgefasst werden.
In den bisherigen Beispielen gab es je zwei identische Mesomere Grenzstrukturen. Es kann aber auch Beispiele geben, bei denen zwei Grenzstrukturen verschieden sind. Dann müssen die Grenzstrukturen gewichtet werden.
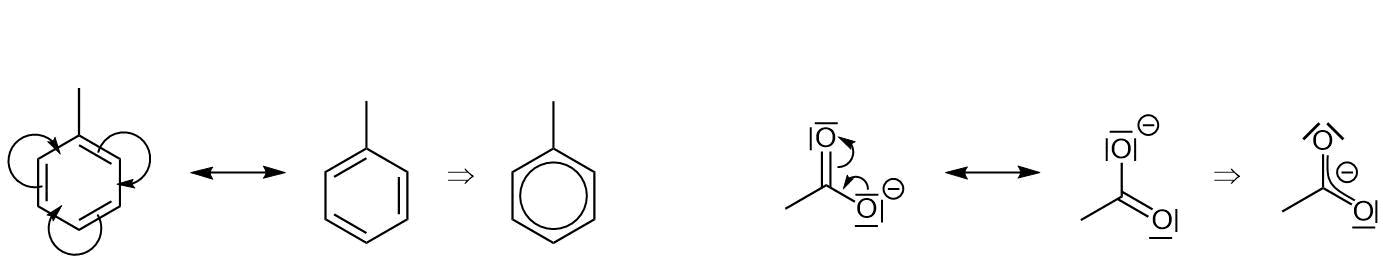
Resonanzformeln des Toluols und Acetats (ein Carboxylat)
Auf der nächsten Seite finden wir einige Regeln (i) zum Aufstellen von Grenzstrukturen und (ii) zur Bewertung von Grenzstrukturen.
Resonanzformeln II
Bei der Aufstellung von Grenzstrukturen sind folgende Regeln zu beachten:
- Jede Grenzstruktur trägt zur Stabilisierung des Gesamtsystems bei. Je mehr Grenzstrukturen existieren desto stabiler ist das System.
- Resonanzstrukturen beschreiben unterschiedliche Elektronenverteilungen bei gleicher Molekülgeometrie.
- Grenzstrukturen welche die Oktett-Regel (Dublett Regel) erfüllen werden stärker gewichtet, sind also realitätsnäher, als andere (1.Priorität).
- Grenzstrukturen ohne Ladungstrennung werden stärker gewichtet als solche mit Ladungstrennung (2.Priorität).
- Tritt eine Ladungstrennung auf, so wird diejenige Grenzstruktur stärker gewichtet bei der die negative Ladung am Atom mit der höheren Elektronegativität lokalisiert ist (3. Priorität).
- Mesomere Grenzstrukturen werden durch einen Doppelpfeil (↔) zwischen einander als solche kenntlich gemacht. Der Doppelpfeil ist ein eigenständiges Symbol und darf auf keinen Fall mit einem Reaktionspfeil oder Gleichgewichtspfeil verwechselt oder gleichgesetzt werden.
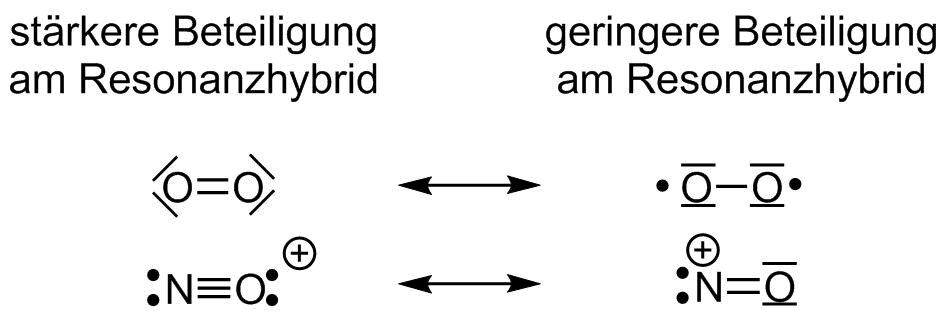
Resonanzformeln mit und ohne Erfüllung der Oktettregel
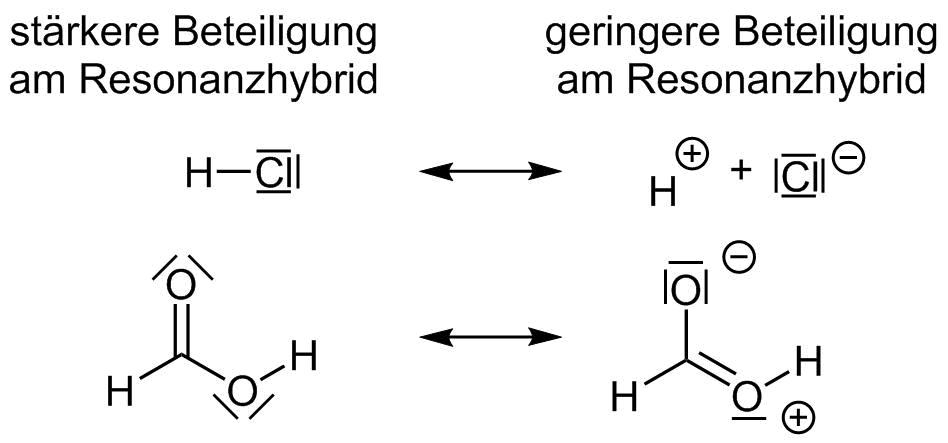
Resonanzformeln mit und ohne Ladungstrennung
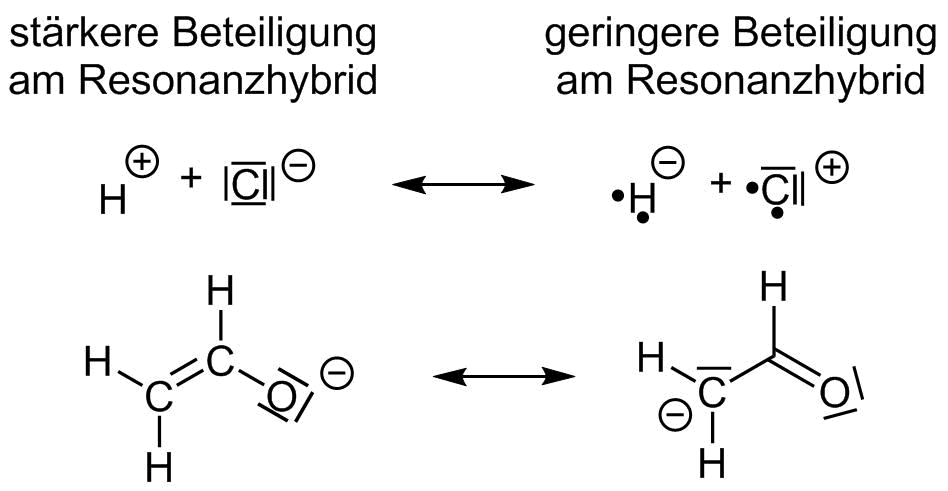
Resonanzformeln mit günsiger und ungünstiger Ladungstrennung
Auf der nächsten Seite wird diue Bedeutung der Mesomerie noch einmal erläutert.
Bedeutung von Grenzstrukturen
Warum beschäftigen wir uns so intensiv mit Grenzstrukturen. Die Beantortung der Frage hat mehrere Aspekte.
-
Können wir Resonanzstrukturen zeichnen, so sind Moleküle
besonders stabil. Dies hat direkte Auswirkungen auf die Reaktivität.
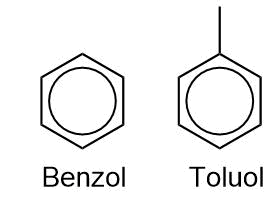
Benzol und Toluol haben formal Doppelbindungen. Diese sind aber durch Mesomerie stabilisiert und delokalisiert. Benzol und Toluol haben eine andere chemische Reaktivität als Alkene (Moleküle mit Doppelbindung)
-
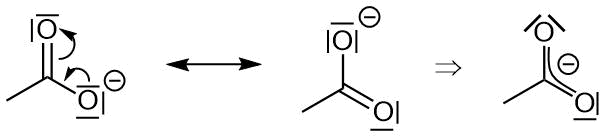
Im Carboxylat finden wir eine negative Ladung. Diese ist über
zwei Atome delokalisiert. Jedes Atom hat nur eine halbe negative Ladung.
-
Die Gewichtung von Grenzstrukturen erlaubt es uns, Vorhersagen zur Ladungsverteilung
in einem Molekül zu machen.
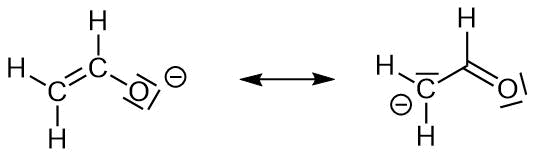
In der linken Grenzstruktur trägt Sauerstoff die negative Ladung, rechts Kohlenstoff. Da Sauerstoff elektronegativer ist als Kohlenstoff, ist die linke Grenzstruktur wichtiger. Daher ist das Sauerstoffatom stärker negativ gealden als das Kohlenstoffatom. Auch dies hat direketen Einfluß auf die Reaktivität des Moleküls.
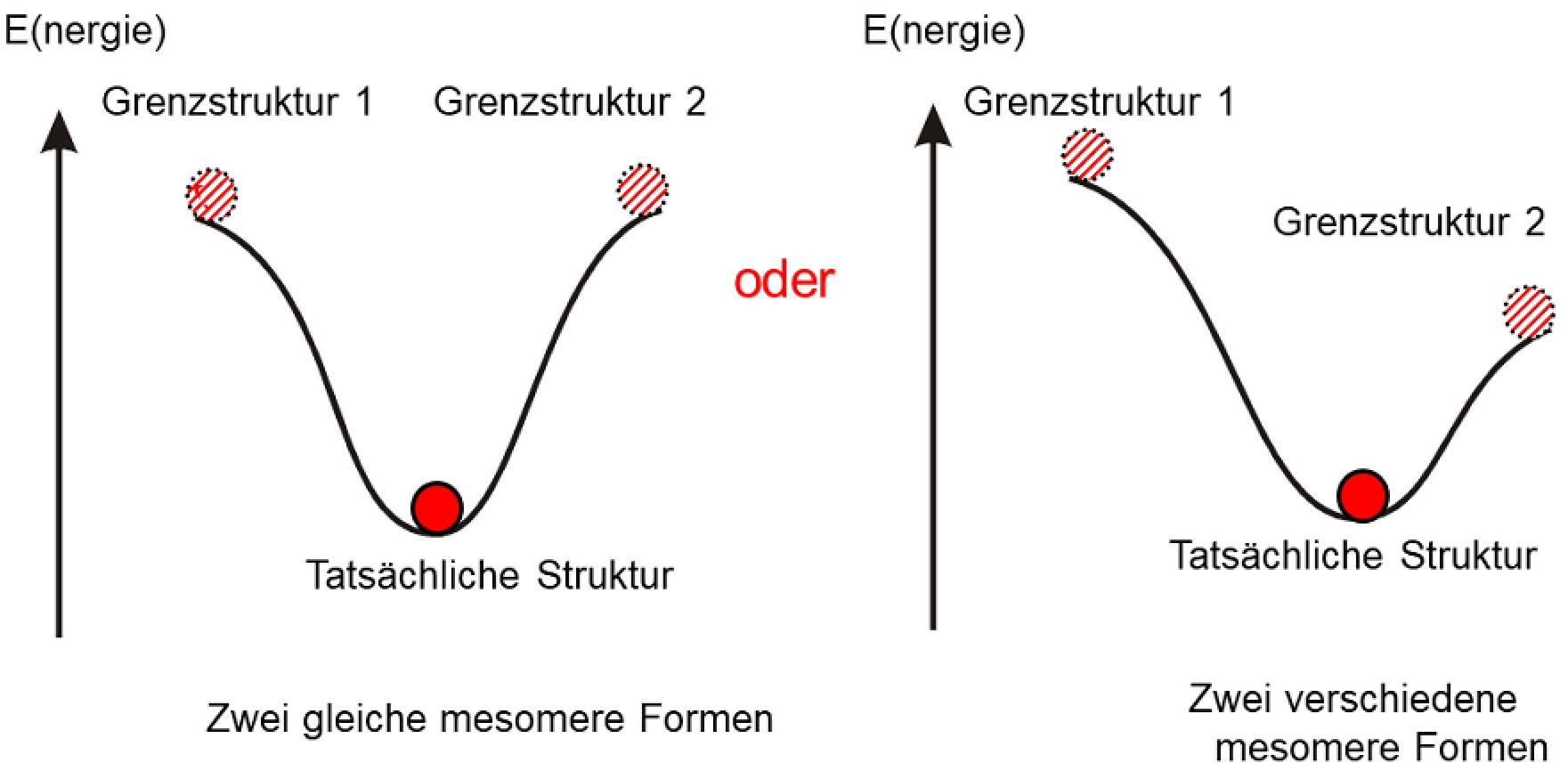
Wenn zwei verschiedene Grenzstrukturen vorliegen, dann ist diejenige die wichtigere, die energetisch günstiger ist (näher am Minimum). - ...
Auf der nächsten Seite findet Ihr noch einen Abschlusstest zu diesem Kapitel.
Abschlusstest
scheLM Multiple Choice
Im folgenden gibt es einen Muliple-Choice-Tests mit 15 Fragen zur Mesomerie.
Die Tests können mehrfach bearbeitet weden. Die Fragen verändern sich. Zur Bearbeitung des Tests müsst Ihr Euch anmelden.
Im nächsten Kapitel findet Ihr eine Wiederholung zur VSEPR-Theorie