Lernziele
Lernziele
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- die Rotation um die zentrale Kohlenstoff-Kohlenstoff-Bindung in Butan zu beschreiben,
- die relative Energie der Konformeren (synperiplanar, gauche/synklinal, antiklinal und antiperiplanar) qualitativ anzugeben,
- die synperiplanare Konformation von Butan als Newman-Projektion, als Sägebock-Projektion und in der Keilstrich-Schreibweise erkennen, richtig benennen und zeichnen zu können,
- die synklinale Konformation (gauche) von Butan als Newman-Projektion, als Sägebock-Projektion und in der Keilstrich-Schreibweise erkennen, richtig benennen und zeichnen zu können,
- die antiklinale Konformation von Butan als Newman-Projektion, als Sägebock-Projektion und in der Keilstrich-Schreibweise erkennen, richtig benennen und zeichnen zu können und
- die antiperiplanare Konformation von Butan als Newman-Projektion, als Sägebock-Projektion und in der Keilstrich-Schreibweise erkennen, richtig benennen und zeichnen zu können.
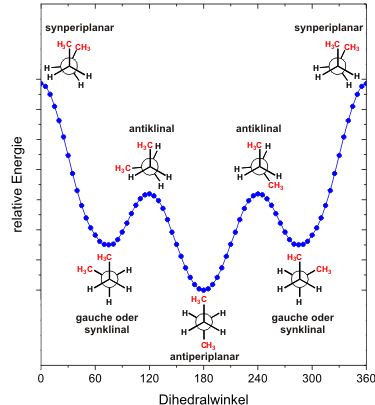
Auf der nächsten Seite findet Ihr einen prinzipiellen Vergleich zu den Konformationen im Ethan und Butan.
Einleitung
Im vorangegangenen Kapitel wurden die Konformationen des Ethans diskutiert. Es besteht die Möglichkeit der Rotation um die Kohlenstoff-Kohlenstoff-Einfachbindung. Durch diese Rotation entstehen drei identische ekliptische Formen und drei identische gestaffelte Konformationen.
Im Butan ist die Situation komplexer. Hier existieren drei
Kohlenstoff-Kohlenstoff-Einfachbindungen, um die rotiert werden
kann. Bei der Rotation um die beiden ässeren
Kohlenstoff-Kohlenstoff-Einfachbindungen ist die Situation vergleichbar
mit der Situation im Ethan:
Es existieren
drei identische ekliptische Konformationen und
drei identische gestaffelte Konformationen.
Diese werden hier nicht diskutiert.
Die Rotation um die zentrale
Kohlenstoff-Kohlenstoff-Einfachbindung liefert ein komplexeres Bild.
Es gibt zwei verschiedene gestaffelte und zwei verschiedene
ekliptische Anordnungen.
Dies wird im folgenden ausführlich diskutiert.
Auf der nächsten Seite findet Ihr eine kurze Einführung zur konformativen Beweglichkeit im Butan.
Ein erster Eindruck
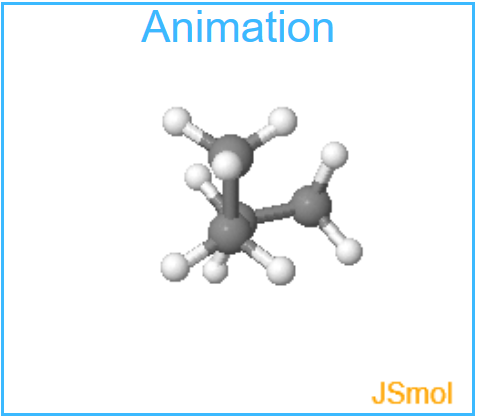
Aufgabe: Starten Sie die Animation und drehen Sie Butan so, dass
Sie es in verschiedenen Blickwinkeln betrachten können.
Behalten Sie auch den verlauf der Energiekurve im Auge.
So gewinnen Sie einen ersten Eindruck von den konformativen Veränderungen.
Aufgabe: Gehen Sie jetzt zurück zur Startgeometrie!
Auf den nächsten Seiten werden Sie dazu aufgefordert, das Molekül
in bestimmte Blickrichtungen zu drehen. Zusätzlich gibt es Buttons,
die die gewünschte Blickrichtung einstellen.
Bitte nutzen Sie diese Button nur im "Notfall", oder um Ihr Ergebniss zu
überprüfen.
Die Hand-Auge-Koordination beim selbständigen Drehen des Moleküls
hilft, die dreidimensionalen Strukturen zu erkennen. Darauf sollten
Sie nicht verzichten.
Auf der nächsten Seite wird die synperiplanare Anordnung von Butan diskutiert.
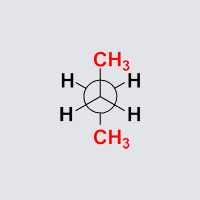
Synperiplanare Anordnung
Aufgabe: Drehen Sie Butan so, dass die Anordnung einer Newman-Projektion, einer Sägebock-Projektion und einer Keilstrichprojektion entspricht!
Butan synperiplanar
Butan synperiplanar
Butan synperiplanar
Beobachtung: Die beiden endständigen Methylgruppen stehen ekliptisch und genauso stehen jeweils zwei Paare von Wasserstoffatomen ekliptisch. Dies sieht man besondes gut, wenn man Butan in eine Anordnung dreht, die einer Newman-Projektion entspricht.
Die beiden Methylgruppen stehen ekliptisch und damit auf der selben Seite
(Dihedralwinkel 0°, syn) des Moleküls und in einer Ebene (periplanar) mit
den beiden Kohlenstoffatomen der zentralen Einfachbindung.
Diese Anordnung heißt daher synperiplanar.
Diese Anordnung stellt das Maximum auf der Energiekurve da!
* Die beiden CH3-Gruppen stehen ekliptisch. In der Newman-Projektion werden Sie leicht verdrillt gezeichnet, da es nicht möglich ist, sie direkt hintereinander darzustallen.
Auf der nächsten Seite wird die antiperiplanare Anordnung von Butan diskutiert.
Antiperiplanare Anordnung
Aufgabe: Starten Sie die Animation und stoppen Sie diese in der antiperiplanaren Anordnung.
Aufgabe: Drehen Sie Butan so, dass die Anordnung einer Newman-Projektion, einer Sägebock-Projektion und einer Keilstrichprojektion entspricht!
Butan antiperiplanar
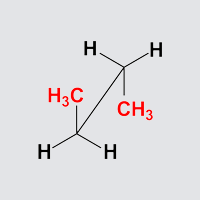
Butan antiperiplanar
Butan antiperiplanar
Beobachtung: Die Reste am vorderen Kohlenstoff (einmal Methyl,
zweimal Wasserstoff) und am hinteren Wasserstoff (einmal Methyl,
zweimal Wasserstoff) stehen gestaffelt.
Dabei haben die beiden Methylgruppen den größt möglichen
Abstand.
Dies sieht man besondes gut, wenn man Butan in eine Anordnung dreht,
die einer Newman-Projektion entspricht.
Die beiden Methylgruppen stehen jeweils ekliptisch zu
Wasserstoffatomen am benachbarten Kohlenstoffatom. Sie stehen
einander gegenüber (Dihedralwinkel 180°, anti) und bilden
mit den zentralen Kohlenstoffatomen eine Ebene (periplanar).
Diese Anordnung heißt daher antiperiplanar.
Diese Anordnung stellt das Minimum der Energiekurve da!
Auf der nächsten Seite wird die antiklinale Anordnung von Butan diskutiert.
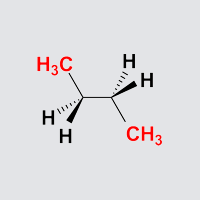
Antiklinale Anordnungen I
Aufgabe: Starten Sie die Animation und stoppen Sie diese in einer der antiklinalen Anordnungen.
Aufgabe: Drehen Sie Butan so, dass die Anordnung einer Newman-Projektion,
einer Sägebock-Projektion und einer Keilstrichprojektion entspricht!
Hinweis: Die Anordnung in den drei Bildern entspricht der ersten der
beiden antiklinalen Anordnungen auf der EWnergiekurve. Mehr Informationen
hierzu finden Sie auf der nächsten Seite.
Butan antiklinal
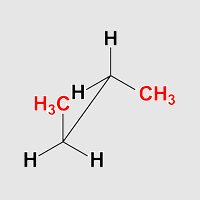
Butan antiklinal
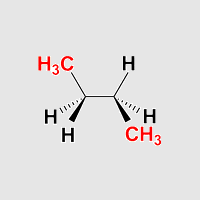
Butan antiklinal
Beobachtung:
Die beiden Methylgruppen stehen jeweils ekliptisch mit einem Wasserstoffatom
am Nachbarkohlenstoff, zusätzlich stehen zwei Wasserstoffatome ekliptisch.
Dies sieht man besondes gut, wenn man Butan in eine Anordnung dreht,
die einer Newman-Projektion entspricht.
Diese Anordnung ist günstiger als die synperiplanare Anordnung,
aber auch hier handelt es sich wieder um ein lokales Maximum
auf der Energiekurve.
Die beiden Methylgrupppen stehen wie in der antiperiplanaren Anordnung
auf verschiedenen Seiten des Moleküls (anti).
Allerdins stehen sie nicht mehr in einer Ebene (periplanar), sondern
um 60° aus der Ebene herausgedreht. Sie stehen jetzt
benachbart (klinal).
Diese Anordnung heißt daher antiklinal.
Auf der nächsten Seite findet Ihr weitere Informationen zur antiklinalen Anordnung.
Antiklinale Anordnung II
Auf der Energiekurve finden sich zwei antiklinale Anordnungen*, die energetisch gleich sind. Neben diesen beiden ekliptischen Anordnungen existiert eine dritte ekliptische Anordnung, die synperiplanare Anordnung.
Diese drei ekliptischen Anordnungen können mit den drei ekliptischen Anordnungen von Ethan verglichen werden. Beim Ethan sind alle drei ekliptische Anordnungen energetisch gleich und nicht unterscheidbar, im Butan gibt es die synperiplanare Anordnung (ungünstigere Anordnung) und zwei antiklinale energiegleiche Anordnungen* (günstigere Anordnungen).
* Die beiden antiklinalen Geometrien erscheinen auf den ersten Blick identisch, tatsächlich handelt es sich aber um Enantiomere. Die beiden Strukturen verhalten sich wie Bild und Spiegelbild.
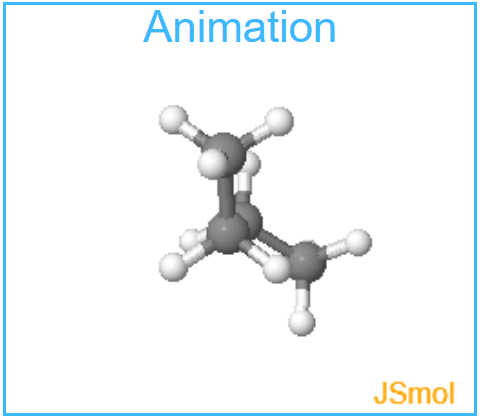
Enantiomer I
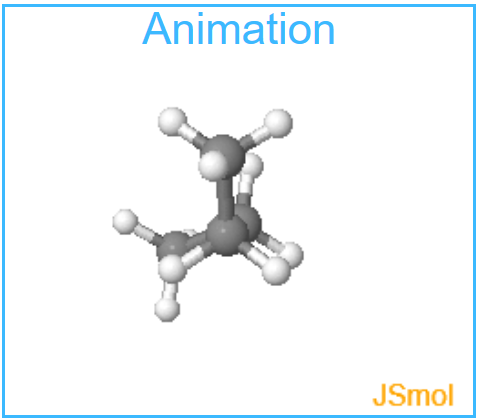
Enantiomer II
Aufgabe: Gegen Sie zu den beiden antiklinalen Geometrien. Drehen Sie das Molekül so, das die Anordnungen dem einem oder anderem Enantiomer entsprechen.
Beobachtung: Die erste der beiden antiklinalen Anordnungen entspricht Enantiomer I, die zweite Enantiomer II. Es ist nicht möglich, Enantiomer I so zu drehen, dass Die Anordnung Enantiomer II entspricht. Es handelt sich um verschiedene Enantiomere, die sich wie Bild und Spiegelbild verhalten.
Die beiden antiklinalen Anordnungen bilden ein Enantiomerenpaar.
Auf der nächsten Seite wird die synklinale (gauche) Anordnung von Butan diskutiert.
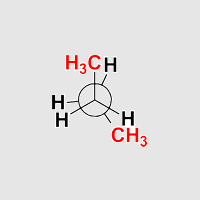
Synklinale oder gauche Anordnung, Teil I
Aufgabe: Starten Sie die Animation und stoppen Sie diese in einer der synklinalen (gauche) Anordnungen.
Aufgabe: Drehen Sie Butan so, dass die Anordnung einer Newman-Projektion, einer Sägebock-Projektion und einer Keilstrichprojektion entspricht!
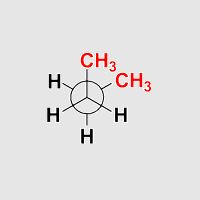
Butan synklinal
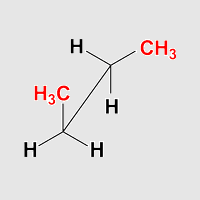
Butan synklinal
Butan synklinal
Beobachtung: Die Anordnung ist gestaffelt. Eine Methylgruppe
steht jeweils zwischen einem Wasserstoffatom und einer
Methylgruppe am Nachbaratom. Dies sieht man besonders gut, wenn man Butan
in eine Anordnung dreht, die einer Newmanprojektion entspricht.
Die Anordung ist ein lokales Minimum auf der Energiekurve.
Die beiden Methylgruppen im Butan stehen auf der gleichen seite des
Moleküls (syn), aber Sie stehen nicht in einer Ebene (periplaner),
sondern benachbart* (klinal).
Daher heißt diese Anordnung synklinal. Als Synonym
wird häufig die Bezeichnung gauche verwendet.
* Die benachbarte Anordnung ist hier augenscheinlicher als in der antiklinalen Anordnung.
Auf der nächsten Seite findet Ihr weitere Infomationen zur gauche Anordnung von Butan.
Synklinale oder gauche Anordnung, Teil II
Die Situation bei der synklinalen (gauche) Anordnung ist ähnlich wie bei der antiklinalen Anordnung. Es existieren zwei energetisch identische synklinale (gauche) Anordnungen. Es handelt sich um Isomere, die sich wie Bild und Spiegelbild verhalten. Es sind Enantiomere.
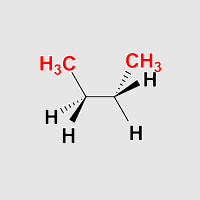
Enantiomer I
Enantiomer II
Aufgabe: Drehen Sie das Molekül so, dass die Ansicht einer Fischerprojektion entspricht. Betrachten Sie in dieser Anordnung die beiden synklinalen (gauche) Anordnungen.
Beobachtung: Die beiden synklinalen Anordnungen verhalen sich wie Bild und Spiegelbild und lassen sich nicht zur Deckung bringen.
Die beiden synklinalen (gauche) Anordnungen bilden ein Enantiomerenpaar.
Auf der nächsten Seite findet Ihr eine kurze Zusammenfasung.
Zusammenfassung
- Im Ethan (vorangegangenes Kapitel) gibt es drei ekliptische Anordnungen (energetisch ungünstig) und drei gestaffelte Anornungen (energetisch günstig).
- Auch im Butan finden sich drei gestaffelte Anordnungen und drei ekliptische Anordnungen.
- Auch im Butan sind die ekliptischen Anornungen energetisch ungünstig und die gestaffelten Anordnungen energetisch günstig.
-
Es gibt drei ekliptische Anordnungen, eine synperiplanare und zwei
antiklinale.
- Die synperiplanare Anordnung ist ungünstiger als die antiklinalen Anordnungen.
- Dies kann auf die sterische Repulsion der Methylgruppen zurüchgeführt werden.
- Die beiden antiklinalen Anordnungen bilden ein Enantiomerenpaar.
-
Es gibt auch drei gestaffelte Anordnungen, eine antiperiplanare und
zwei synklinale (gauche).
- Die antiperiplanare Anordnung ist energetisch günstiger als die beiden synklinalen (gauche) Anordnungen.
- Dies kann auf die sterische Repulsion der Methylgruppen zurüchgeführt werden.
- Die beiden synklinalen (gauche) Anordnungen bilden ein Enantiomerenpaar.
Auf der nächsten Seite findet Ihr einen Abschlusstest.
Abschlusstest
scheLM Multiple Choice
Bevor Ihr im Inhalt weiter geht, hier noch ein kurzer Wiederholungstest mit Fragen zu den Konformationen des Butans.
Im nächsten Kapitel wird der Begriff Konstitutionsisomere eingeführt.