Wiederholungstest
scheLM n2s (Nomenklatur)
Dieser Test wiederholt noch einmal zehn Beispiele zur Nomenklatur von Alkanen und Cycloalkanen. In diesem Kapitel wird dann die Nomenklatur der ersten funktionellen Gruppen eingeführt.
Auf der nächsten Seite findet Ihr die Lernziele.
Lernziele
Lernziele
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- organische Alkohole und Ether zu erkennen und zu benennen,
- deren Eigenschaften zu erläutern,
- sowie typische Merkmale und Einsatzgebiete aufzählen zu können.
Auf der nächsten Seite wird die Nomenklatur der Alkohole eingeführt.
Bezeichnung

Genealogisch lassen sich Alkohole von Wasser ableiten. Sie entstehen formal dadurch, dass im Wasser-Molekül ein Wasserstoffatom durch einen organischen Rest substituiert wird. Alkohole sind sauerstoffhaltige Verbindungen, wobei der Sauerstoff in Form von einer ()oder mehreren) sog. Hydroxygruppe (veraltet Hydroxylgruppe) an einem Kohlenstoffatom gebunden ist.
Nomenklatur von Alkoholen:
- Vorhandene funktionelle Gruppen werden in einem Molekül durch die Vorsilbe (Hydroxy-) oder die Nachsilbe (-ol) kenntlich gemacht.
- Man nutzt dabei bevorzugt die Nachsillbe. Das bedeutet, man sagt Ethanol statt Hydroxyethan.
-
Wenn nötig gibt man die Position der Hydroxygruppe im
Molekül an. Nachfolgend sind die Isomere 1-Propanol und 2-Propanol
dargestellt.
Strukturformel Bezeichnung 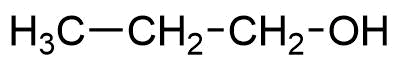
1-Propanol / n-Propylalkohol 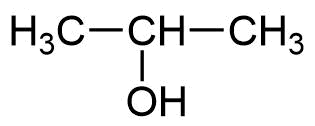
2-Propanol / Isopropylalkohol -
1-Propanol wird auch als n-Propanol bezeichnet. An der Hydroxygruppe hängt
ein n-Propyl-Rest (oder auch nur Propyl-Rest).
2-Propanol wird auch als Isopropanol bezeichnet. An der Hydroxygruppe hängt ein Isopropyl-Rest. -
In Analogie dazu wird 1-Butanol auch als n-Butanol bezeichnet und 2-Butanol als sec-Butanol
(die Hydroxygruppe trägt einen sec-Butyl-Rest).
Strukturformel Bezeichnung 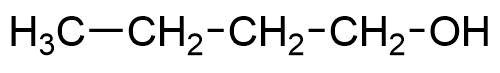
1-Butanol / n-Butylalkohol 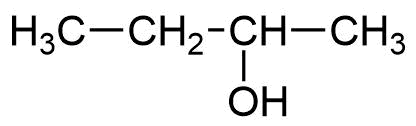
2-Butanol / sec-Butylalkohol -
Die Position der Hydroxygruppe wird durch eine möglichst kleine Zahl dargestellt.
Es heißt also 1-Butanol und nicht 4-Butanol, sowie 2-Butanol statt 3-Butanol.
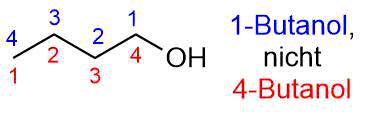
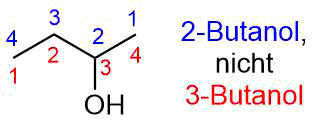
Hat ein Molekül mehrere funktionelle Gruppen, dann kann ein Molekül auch mehrere Vorsilben, aber immer nur eine Nachsillbe tragen. Dies spielt hier noch keine Rolle (wir haben erst eine funktionelle Gruppe kennengelernt), wird aber später wichtig.
Eine Ausnahme bei der Bezeichnung bildet hierbei ein mit einer Hydroxygruppe
substituierter aromatischer Ring. Solche Systeme werden
als Phenole bezeichnet.
Aromaten und Phenole werden später behandelt.
Auf der nächsten Seite werden die Begriff primärer, sekundärer und tertiärer Alkohol eingeführt.
Wertigkeit
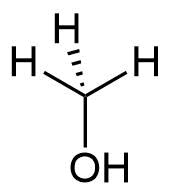
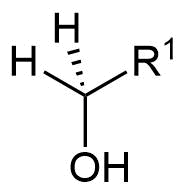
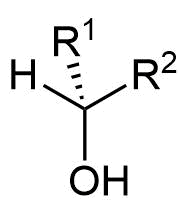
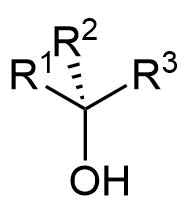
Alkohole werden in primäre, sekundäre und tertiäre Alkohole unterschieden. Hierfür werden die Nichtwasserstoffnachbarn des sauerstofftragenden Kohlenstoffatoms betrachtet.
- Befindet sich ein organischer Rest am Kohlenstoff, handelt es sich um einen primären Alkohol,
- bei zwei organischen Resten ist es ein sekundärer
- und bei drei organischen Resten ein tertiärer Alkohol.
|
|
 |
 |
| Methanol | primärer Alkohol | sekundärer Alkohol | tertiärer Alkohol |
Allgemeine Formeln zur Verdeutlichung der Wertigkeit von Alkoholen
Abgebildet sind von links nach rechts Methanol und die allgemeinen Formeln eines primären Alkohols, eines sekundären Alkohols und eines tertiären Alkohols. Die Organyl-Reste R¹ bis R³ können dabei Alkyl-, Alkenyl-, Aryl-Reste etc. sein. Die Begriffe Alkenyl- und Aryl-Reste werden später definiert.
Auf der nächsten Seite erfahrt Ihr mehr über die Eigenschaften von Alkoholen.
Polarität / Wasserstoffbrückenbindungen
Aufgrund der ungleichen Ladungsverteilung ist die Hydroxygruppe eines Alkohols polar. Daraus resultiert die Fähigkeit zu ebenfalls polaren Wassermolekülen gut Wasserstoffbrückenbindungen ausbilden zu können, was die gute Löslichkeit von kurzkettigen Alkoholen in Wasser erklärt. Je mehr Hydroxygruppen ein Alkohol aufweist, desto mehr Wasserstoffbrücken kann dieser mit Wasser und anderen Wasserstoffbrückenausbildenden Molekülen ausbilden.
Je mehr Hydroxygruppen der Alkohol trägt, desto hydrophiler ist das
Molekül.
Je länger die Alkylkette, desto hydrophober das Molekül.
Verglichen mit Alkanen sind kurzkettige Alkohole gut wasserlöslich. Bis C3 sind primäre Alkohole vollständig mit Wasser mischbar. Mit Hilfe der Polarität im Molekül lässt sich dies erklären. Die Polarität sinkt von einer relativ hohen Polarität im Methanol zu deutlich geringeren Polaritäten, wodurch Butan-1-ol schon nur noch wenig in Wasser löslich ist.
Die polare Hydroxygruppe ist zudem in der Lage Wasserstoffbrückenbindungen auszubilden. Je kürzer die Alkankette an der OH-Gruppe, desto größer ist die Wirkung der Wasserstoffbrückenbindungen.
Verglichen mit Alkanen ähnlicher Molmasse haben Alkohole aufgrund dieser Wechselwirkungen einen deutlich höheren Siedepunkt. In der Tabelle findet Ihr in jeder Zeile ein Alkan mit einem Alkohol ähnlicher Molmasse und die zugehörigen Siedepunkte.
| Alkane | Alkohole | ||||
| Name | Molmasse | Siedepunkt | Siedepunkt | Molmasse | Name |
| Ethan | 30 g/mol | -89 °C | 65 °C | 32 g/mol | Methanol |
| Propan | 44 g/mol | -42 °C | 78 °C | 46 g/mol | Ethanol |
| Butan | 58 g/mol | -1 °C | -97 °C | 60 g/mol | 1-Propanol |
Auf der nächsten Seite werden Ether eingeführt.
Ether
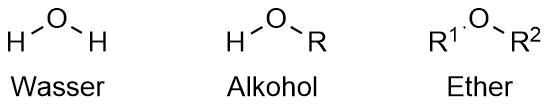
Genealogisch sind Ether wie schon die Alkohole von Wasser ableitbar. Dies geschieht formal durch den Austausch beider Wasserstoffatome gegen organische Reste.

sp³-Hybridisierung von Wasser und allgemeinen Ethern
Genau wie H2O sind auch Alkohole und Ether gewinkelt angeordnet, da das Sauerstoffatom als sp³-hybridisiert aufgefasst werden kann. Siehe dazu "Struktur und Bindung - Molekülgeometrie, Seite 16".
Nomenklatur von Ethern:
- Aliphatische Ether werden nach der IUPAC-Nomenklatur als Alkoxyalkane bezeichnet.
-
Bei unsymetrischen Ethern (R¹-O-R²) wird der höherrangige Substituent
R¹ als Alkan-Kette betrachtet und bildet den Stamm des Stoffnamens.
Der niederrangigere Substituent der Kette ist der Alkoxy-Rest.
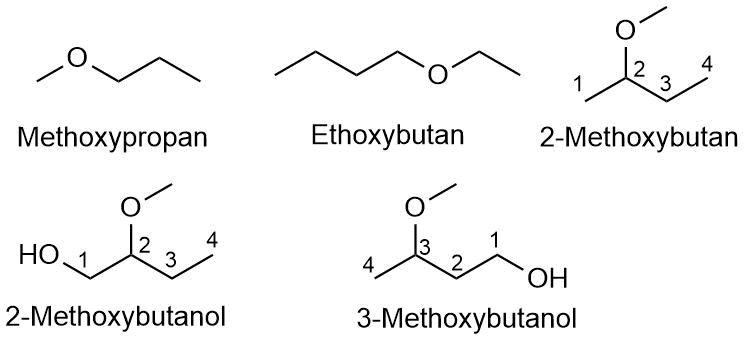
Beispiele zur Nomenklatur von Ethern
- Wenn nötig wird die Position der Alkoxygruppe angegeben. Dabei bekommt sie eine möglichst niederige Zahl.
-
In einfachen Molekülen kann und wird in der Regel eine alternative Bennenung genutzt.
Anstelle von Methoxypropan sagt man Methylpropylether. Man hat also ein Ethersauerstoff mit
einem Methylrest und einem Propylrest.
Analog heißt es Ethylbutylether und Methyl-2-butylether. -
Ist ein Molekül gleichzeitig ein Ether und ein Alkohol, so hat die Alkoholgruppe
bei der Benennung Priorität.
- Daher kann man die Beispiele in der zweiten Reihe nicht als ...ether bezeichnen.
- Der Name muss auf ...ol enden.
- Die einzig mögliche Bezeichnung für die Ether Gruppe ist dann als Alkoxy... .
- Diese Moleküe werden so nummeriert, dass die Hydroxygruppe eine möglichst kleine Nummer bekommt (Hier jeweiles die 1).
- Zur Benennung symmetrischer Ether wird der Präfix Di- genutzt. Es heißt dann z. B. Diethylether.
Als wichtigster Vertreter der organisch-chemischen Verbindungsklasse der Ether wird Diethylether häufig auch einfach nur als Ether bezeichnet.
Physikalische Eigenschaften
Ether sind genau wie Alkohole H-Brücken-Akzeptoren, allerdings keine H-Brücken-Donoren. Somit findet bei Ethern keine Eigenassoziation, sondern nur eine Mischassoziation mit H-X statt. Durch die fehlende Eigenassoziation ähneln Ether im Schmelzpunkt den korrespondieren Kohlenwasserstoffen.
| Alkan | Ether | ||||||
| Strukturformel | Bezeichnung | Molmasse | Sdp | Sdp | Molmasse | Bezeichnung | Strukturformel |

|
Propan | 44 g/mol | -42 °C | -24 °C | 48 g/mol | Dimethylether |
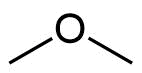
|

|
n-Pentan | 72 g/mol | 36 °C | 35 °C | 74 g/mol | Diethylether |
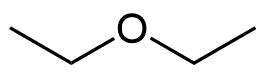
|

|
n-Heptan | 100 g/mol | 98 °C | 91 °C | 102 g/mol | Dipropylether |
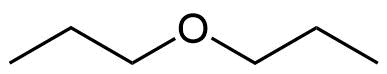
|
Die Kombination von relativ niedrigen Schmelz- und Siedepunkten bei relativer Reaktionsträgheit prädestiniert besonders kurzkettige Ether als Lösungsmittel in der präparativen organischen Chemie.
Auf der nächsten Seite können Sie Beispiele für Ether kennenlernen.
Wichtige Ether
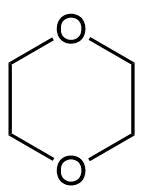
1,4-Dioxan
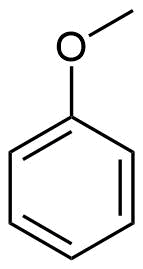
Anisol
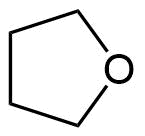
Tetrahydro-furan
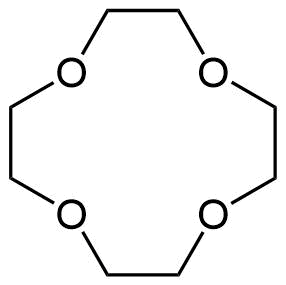
Kronenether
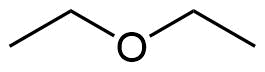
Diethylether
1,4-Dioxan ist eine farblose, niedrigviskose Flüssigkeit. Der Siedepunkt bei Normaldruck beträgt 101 °C. Der cyclische Diether ist beliebig mit Wasser und gut mit den meisten organischen Lösungsmitteln mischbar. Da er relativ inert ist, einen für organische Reaktionen recht hohen Siedepunkt besitzt und aufgrund seiner guten Mischbarkeit mit anderen Lösungsmitteln findet 1,4-Dioxan Verwendung als Lösungsmittel.
Anisol (oder auch Methylphenylether oder Methoxybenzol) ist eine charakteristisch riechende, farblose, entzündliche Flüssigkeit und kann formal als Ether aus Phenol und Methanol aufgefasst werden. Wie 1,4-Dioxan wird Anisol als Lösungsmittel, mit einem relativ hohen Siedepunkt von 154 °C verwendet. Ebenfalls möglich ist die Verwendung als Wärmeübertragungsmittel (im Bereichen zwischen 150 und 260 °C) und Ausgangsstoff für die Synthese organischer Verbindungen wie beispielsweise Arzneimitteln und Riechstoffen.
Tetrahydrofuran (gebräuchliche Abkürzung THF) ist eines der wichtigsten organischen Lösungsmittel für Reaktionen mit basischen und neutralen Reaktanten. Es besitzt gute Lösungseigenschaften und ist weitgehend inert. Lediglich im sauren Milieu bildet es oft Säure-Base-Addukte. Bei Verwendung von stark (lewis-)sauren Reaktanten muss mit einer Spaltung des Ethers gerechnet werden. Ebenfalls Verwendung findet THF als Vorprodukt in der Synthese einiger Polymere.
Kronenether Kronenether sind cyclische Ether die aus einer Abfolge von Ethylenoxyeinheiten bestehen. Benannt sind sie nach ihrem kronenartigen Aufbau. Der hier abgebildete Ether ist heißt [12]Krone-4 oder (1,4,7,10-Tetraoxacyclododecan). Er ist der kleinste gängige Vertreter der Kronenether. Verwendung finden Kronenether in der Komplexchemie zur Stabilisierung von Metall-Kationen.
Diethylether ist der wichtigste Vertreter der Verbindungsklasse der Ether.
Auf der nächsten Seite findet Ihr einen Abschlusstest zu diesem Kapitel.
Abschlusstest
scheLM FG
Bei scheLM FG handelt es sich um einen Trainer für funktionelle Gruppen.
Dieser Trainer kennt sechs verschiedene Modi, in diesem Test werden fünf Beispiele abgefragt, dabei wird der aktuelle Modus für jedes Beispiel zufällig ausgewählt. Es stehen folgende sechs Modi zur Verfügung:
- Gegeben: Funktionelle Gruppe - Gesucht: Name
- Gegeben: Funktionelle Gruppe - Gesucht: Vorsilbe
- Gegeben: Funktionelle Gruppe - Gesucht: Nachsilbe
- Gegeben: Name - Gesucht: Funktionelle Gruppe
- Gegeben: Vorsilbe - Gesucht: Funktionelle Gruppe
- Gegeben: Nachsilbe - Gesucht: Funktionelle Gruppe
scheLM n2s (Nomenklatur)
Es folgt ein scheLM n2s (Nomenklatur) Test. Im Gegensatz zum scheLM n2s Vokabeltrainer
geht es hier nicht um das Auswendiglernen von Begriffen, sondern
um das Anwenden und üben von Nomenklaturkenntnissen. Daher sollen hier nicht immer
gleiche Beispiele geübt werden, sondern die Fähigkeiten soollen an immer neuen
Beispielen eingeübt werden.
Daher werden hier die Ergebisse nicht protokolliert und eine Anmeldung
ist nicht erforderlich.
Der Test kann beliebig oft wiederholt werden. Bei einer Wiederholung werden andere Fragen gestellt.
Zunächst fünf einfachere Beispiele mit einer funktionellen Gruppe.
Im nächsten Kapitel findet Ihr Informationen zu Reaktionen von Alkoholen und Ethern.