Wiederholungstest
scheLM FG
Dieser scheLM FG Test ist eine Wiederholung des Abschlusstests des Kapitels Alkohole und Ether - Einleitung.
Lernziele
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- organische Schwefelverbindungen zu erkennen,
- deren Eigenschaften zu erläutern,
- sowie typische Merkmale und Einsatzgebiete aufzählen zu können.
Sauerstoff und Schwefel
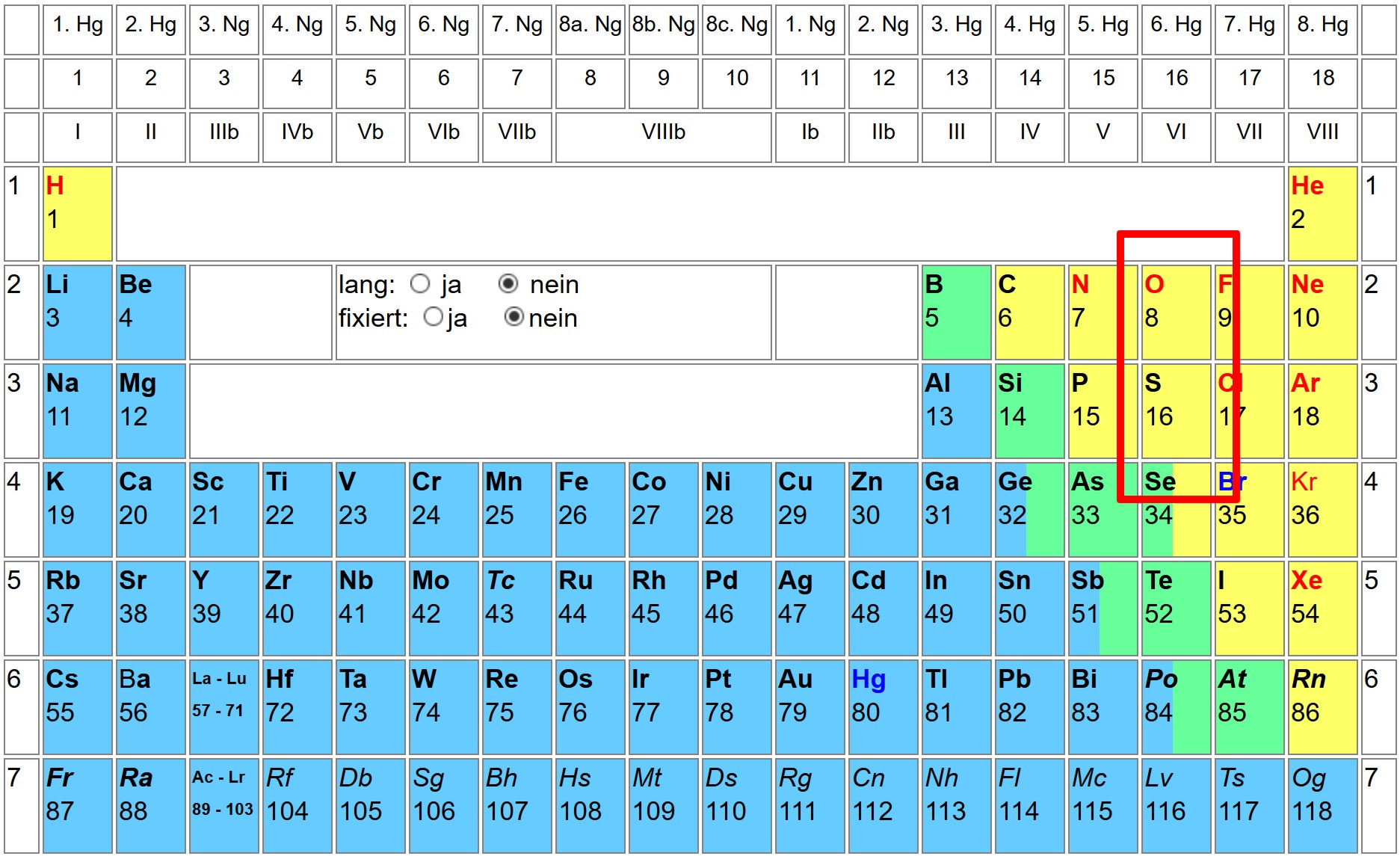
Sauerstoff und Schwefel im PSE
Sauerstoff O und Schwefel S sind im PSE in der gleichen Hauptgruppe angesiedelt. Dennoch existieren wichtige Unterschiede zwischen den beiden Elementen. Sauerstoff befindet sich in der 2. Periode und liegt zweibinding vor. Für das Atom gilt die Oktettregel streng. Schwefel ist in der 3. Periode angesiedelt, kann sowohl neutral, wie auch zwei-, vier- und sechsbindig vorliegen.
Auch hinsichtlich der Elektronegativitäten EN sind Sauerstoff und Schwefel unterschiedlich. Die Elektronegativität von Sauerstoff liegt bei 3.5, währenddessen die von Schwefel bei 2.5 liegt. Dies entspricht dem Trend, dass die Elektronegativität von unten nach oben hin zunimmt.
Einleitung
Das Element Schwefel hat das Symbol S und ist in der
6. Hauptgruppe des Periodensystems
(siehe scheLM PSE) angesiedelt. Elemente der
6. Hauptgruppe werden auch als Chalkogene bezeichnet. Elementarer
Schwefel liegt als gelber, nichtmetallischer Feststoff vor und kommt
auch in vielen Modifikationen vor. So ist das Element Schwefel in
bestimmten
 proteinogenen Aminosäuren und auch Coenzymen enthalten. Als Beispiele
hierfür können die beiden Aminosäuren Cystein und Methionin
genannt werden. Ein Coenzym mit einem Schwefelatom ist beispielweise
das Coenzym A (hier nicht gezeigt).
proteinogenen Aminosäuren und auch Coenzymen enthalten. Als Beispiele
hierfür können die beiden Aminosäuren Cystein und Methionin
genannt werden. Ein Coenzym mit einem Schwefelatom ist beispielweise
das Coenzym A (hier nicht gezeigt).
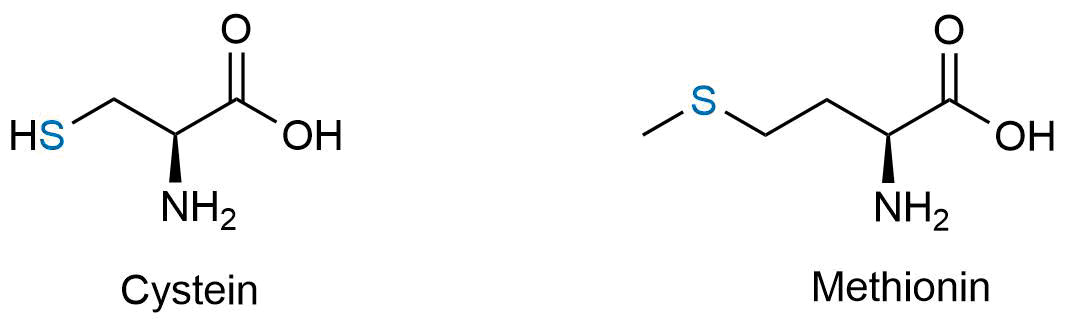
Beispiele für Aminosäuren mit einem Schwefelatom
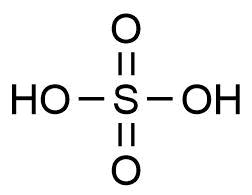
Summenformel von Schwefelsäure
Dieser Link muss spaeter noch mal angepasst werden.
Im vorangegangenen Kapitel haben Sie organische Verbindungen mit dem Element Sauerstoff O kennengelernt. Beispiele hierfür sind Alkohole und Ether. Wird das Sauerstoffatom gegen ein Schwefelatom S ausgetauscht, entstehen analoge Schwefelverbindungen.
Auf den folgenden Seiten könnt Ihr Euch mit der Nomenklautur organischer Schwefelverbindungen vertraut machen.
Nomenklatur - Thiole und Thioether
Die Nomenklatur organischer Schwefelverbindungen entspricht der von organischen Sauerstoffverbindungen, wie bspw. Alkoholen und Ethern.
-
Der Rest HS-
wird als
Mercapto-Gruppe bezeichnet.
Entsprechende Verbindungen heißen in Analogie zu den Alkoholen (siehe dort) Thiole. -
Der Rest RS-
wird als Alkythio-
bzw.
Alkylsulfanyl-Gruppe
bezeichnet.
Entsprechende Verbindungen heißen in Analogie zu den Ethern Thioether.
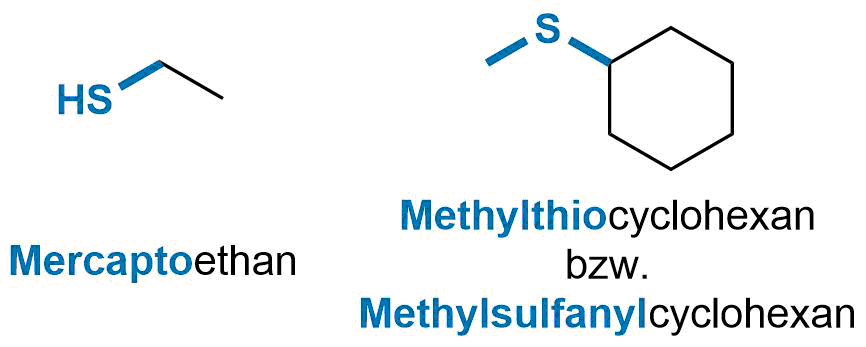
Beispiel für einfache Schwefelverbindungen
Als Wortstamm werden die Bezeichnungen -thiol und -thioether analog zu den Substanzklassennamen benutzt.
| funktionelle Gruppe | Substanzklasse | Vorsilbe | Stammname |
| HS- | Thiol | Mercapto- | -thiol |
| RS- | Thioether | Alkylthio- oder Alkylsulfanyl- | -thioether |
Der Begriff Thio- stammt aus dem Griechischem und bedeutet Schwefel. Thiole stellen die Schwefelanalogen zu den organischen Sauerstoffverbindungen der Alkohole und der Phenole dar. Die OH-Gruppe wurde durch eine SH-Gruppe ersetzt.
Auf der nächsten Seite könnt Ihr weitere organische Schwefelverbindungen kennenlernen.
Nomenklatur - Sulfonsäuren und Sulfonsäureester
Durch den Ersatz einer OH-Gruppe in der Schwefelsäure durch einen organischen Rest ensteht formal eine Sulfonsäure:
- Eine Verbindung mit dem Rest RSO3H wird als Sulfonsäure bezeichnet.
- Eine Verbindung mit dem Rest RSO3R wird als Sulfonsäureester bezeichnet.
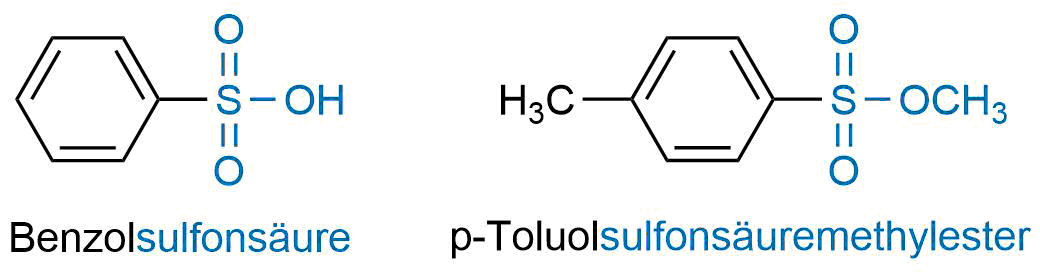
Beispiel für Sulfonsäure und Sulfonsäureester
| funktionelle Gruppe | Substanzklasse | Vorsilbe | Stammname |
| -SO3H | Sulfonsäure | Sulfon- | -sulfonsäure |
| -SO3R | Sulfonsäureester | Sulfon- | -sulfonsäureester |
Sulfonsäuren und deren Derivate haben ein großes Einsatzgebiet in Arzneimitteln und Gerbstoffen. Darüber hinaus werden Sulfonsäuren häufig in Waschmitteln eingesetzt. Die Ester der Sulfonsäuren werden in Weichmachern verwendet.
Auf den folgenden Seiten werden weitere organische Schwefelverbindungen vorgestellt.
Nomenklatur - Disulfid
Eine weitere Gruppe der organischen Schwefelverbindungen stellen die Disulfide dar. Dabei handelt es sich um Verbindungen mit zwei aneinander gebundenen Schwefelatomen.
- Eine Verbindung mit zwei aneinander gebundenen Schwefelatomen R-S-S-R wird als Disulfid bezeichnet.
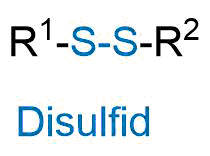
Allgemeines Struktur eines Disulfids

Beispiel für ein Disulfid: Dimethyldisulfid
Bei den Disulfiden können sowohl Alkyl-, Aryl-, Alkaryl- sowie auch Organyl-Reste die beiden Schwefelatome umgeben. Sind die beiden Reste R gleich, wird diese Verbindung als symmetrisches Disulfid bezeichnet. Sind die beiden Reste R ungleich, wird diese als unsymmetrisches Disulfid bezeichnet.
| funktionelle Gruppe | Substanzklasse | Vorsilbe | Stammname |
| -S-S- | Disulfid | Dithio- | -disulfid |
Die Bindung zwischen den beiden Schwefelatomen wird hierbei als Disulfid-Brücke bezeichnet. Disulfidbrücken spielen eine bedeutende Rolle in der Proteinstruktur. Sie stabilisieren die Tertiärstruktur und sind in dieser Funktion beispielweise am typischen Aufbau von Insulin und Lipase beteildigt.
Proteine sind aus Polypeptidsträngen (Ketten aus vielen Aminosäuren) aufgebaut. Näheres wird später ausführlich diskutiert. Innerhalb einer Kette können zwei Thiolgruppen zu einer Disulfidbrücke reagieren.
Disulfidbrücke
Neben den oben genannten Disulfidbrücken innerhalb eines
Proteinstrangs gibt es auch Disulfidbrücken zwischen
Proteinsträngen.
Ein promminentes Beispiel hierfür ist Insulin.
Auf den folgenden Seiten werden Ihnen weitere organische Schwefelverbindungen vorgestellt.
Nomenklatur - weitere funktionelle Gruppen
Drei weitere organische Schwefelverbindungen sind die Sulfoniumsalze, die Sulfoxide und die Sulfone.
- Eine Verbindung mit einem positiv geladenem Schwefelatom und drei Alkylresten R1R2R3S+ wird als Sulfoniumsalz bezeichnet.
- Eine Verbindung mit einem Schwefelatom, einem Sauerstoffatom und zwei Alkylresten R1S(=O)R2 wird als Sulfoxid bezeichnet.
- Eine Verbindung mit einem Schwefelatom, zwei Sauerstoffatomen und zwei Alkylresten R1S(=O)2R2 wird als Sulfon bezeichnet.
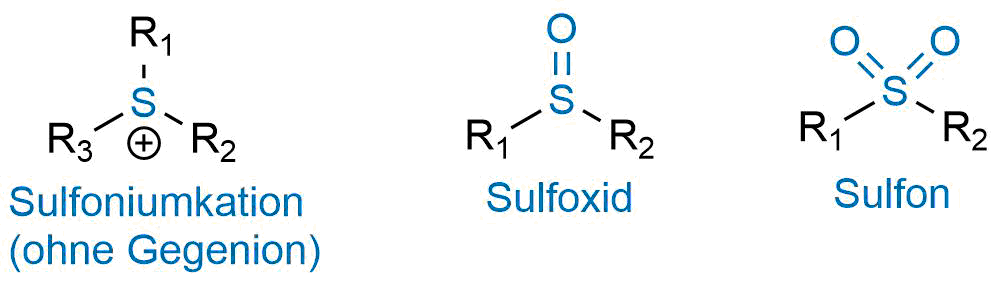
Beispiele für ein Sulfoniumion, Sulfoxid und Sulfon
| funktionelle Gruppe | Substanzklasse | Vorsilbe | Stammname |
| -SR3+ | Sulfoniumion | Sulfonium- | -sulfoniumion |
| -SO | Sulfoxid | -sulfinyl- | -sulfoxid |
| -SO2 | Sulfon | -sulfonyl- | -sulfon |
Sulfoniumverbindungen sind isoelektronisch mit entsprechenden Aminen und haben daher wie diese eine pyramidale Struktur (siehe scheLM 3D - VB-Theorie - 2. Periode). Sie werden als starke Alkylierungsreagenzien eingesetzt.
Ein bekanntes Sulfoxide ist das Lösemittel Dimethylsulfoxid. Andere Derivate finden auch Einsatz in Medikamenten. Ein natürlich vorkommendes Sulfoxid liegt in verschiedenen Laucharten vor, wie in Knoblauch oder Zwiebeln.
Sulfone liegen bei Raumtemperatur meistens fest vor und lassen sich nur schwer oxidieren oder reduzieren. Sie werden in unterschiedlichen Medikamenten eingesetzt.
Auf der nächsten Seite findet Ihr Informationen, wie die prinzipielle funktionelle Gruppe bestimmt wird.
Prinzipielle funktionelle Gruppe
Ein Molekül kann mehrere funktionelle Gruppen enthalten. Dann ist eine funktionelle Gruppe die prinzipielle funktionelle Gruppe, die den Namen der Verbindung definiert. Diese wird durch die Nachsilbe gegeben. Alle anderen funktionellen Gruppen werden als Vorsilbe hinzugefügt.
Als prinzipielle Funktionelle Gruppe wird immer diejenige gewählt, die so hoch wie möglich in der folgenden Tabelle steht.
-
"Onium" und ähnlicheKationen.
- Sulfonium-Kationen
-
Carbonsäuren, dann ihre Schwefel und Selenderivate
- Sulfonsäuren
-
Carbonsäurederivate, dann ihre Schwefel und Selenderivate
- Sulfonsäureester
-
Alkohole und Phenole, dann ihre Schwefel-, Selen und Teluranaloga,
dann Ihre Ester mit anorganischen Säuren.
- Alkohole, Phenole
- Thiol, Thiophenol
Einige funktionelle Gruppen werden nicht als prinzipielle funktionelle Gruppen genutzt. Hier nutzt man in komplexen Molekülen ausschließlich die Vorsilben.
-
Ether, und ihre Schwefel-, Selen- und Teluranaloga.
- Ether
- Thioether
-
Peroxide, und ihre Schwefel-, Selen- und Teluranaloga.
- Peroxid
- Disulfid
-
Weitere.
- -sulfinyl-
- -sulfonyl-
Diese Tabellen sind unvollständig und werden in den folgenden Kapiteln fortlaufend ergänzt.
Auf der nächsten Seite findet Ihr einen Abschlusstest.
Abschlusstest
scheLM FG
Als Abschlusstest zu diesem Kapitel ein scheLM FG Test mit 10 Beispielen! Jedes Beispiel enthält mindestens eine funktionelle Gruppe aus dem aktuellen Kapitel und weitere funktionelle Gruppen zur Wiederholung.
Im nächsten Kapitel findet Ihr eine Übersicht über die Eigenschaften von Thiolen und Thioethern.