Wiederholungstest
scheLM Pairs
Im folgenden findet Ihr zur Wiederholung ein scheLM Pairs Spiel zum Thema Schwefelderivate! scheLM Pairs lehnt sich in seiner Spielidee an Memory© an.
Lernziele
Nachdem Ihr im vorherigen Kapitel die typischen Eigenschaften der organischen Schwefelverbindungen kennengelernt habt, sollt Ihr Euch in diesem Kapitel mit den Synthesen der jeweiligen Verbindungen vertraut machen.
Nach der Bearbeitung dieses Unterkapitels sollen Sie in der Lage sein,
- die Synthesen,
- und typische Reaktionen der organischen Schwefelverbindungen erklären zu können.
Milde Oxidation von Thiolen (Disulfide)
Die Herstellung von Disulfiden verläuft über eine Oxidationsreaktion zweier Thiole. Als Oxidationsmittel kann Iod dienen.
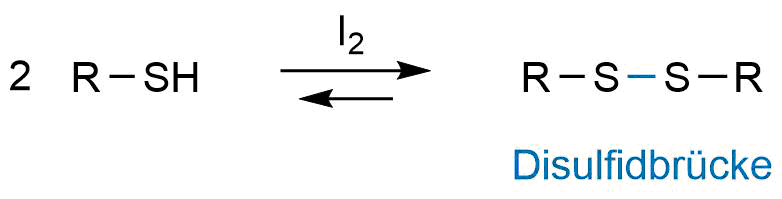
Synthese eines Disulfids
Iod dient hier als schwaches Oxidationsmittel. Weiter schwache Oxidationsmittel sind in der Lage, Thiole zu Disulfiden zu oxidieren. Dazu gehören Eisen III (Fe3+) und Sauerstoff. Bei stehen an der Luft werden Sulfide durch Luftsauerstoff zu Disulfiden oxidiert.
Wie schon in Kapitel Schwefelverbindungen - Einleitung beschrieben, kommen Disulfidbrücken hauptsächlich in Proteinen vor und beeinflussen dort die Tertiärstruktur. Haare bestehen zum größten Teil aus Proteinen. Diese Proteine enthalten Cystein. Wird Cystein oxidiert entsteht Cystin, welches eine kovalente Disulfibrücke aufweist.
Wird beim Friseur eine Dauerwelle gemacht, funktioniert dies nach dem gleichen Prinzip. Zuerst werden die "alten" Brücken durch Reduktion aufgebrochen. Im Anschluss wird das Haar in die gewünschte Form gebracht: Durch Oxidation entstehen neue kovalenten Disulfidbrücken.
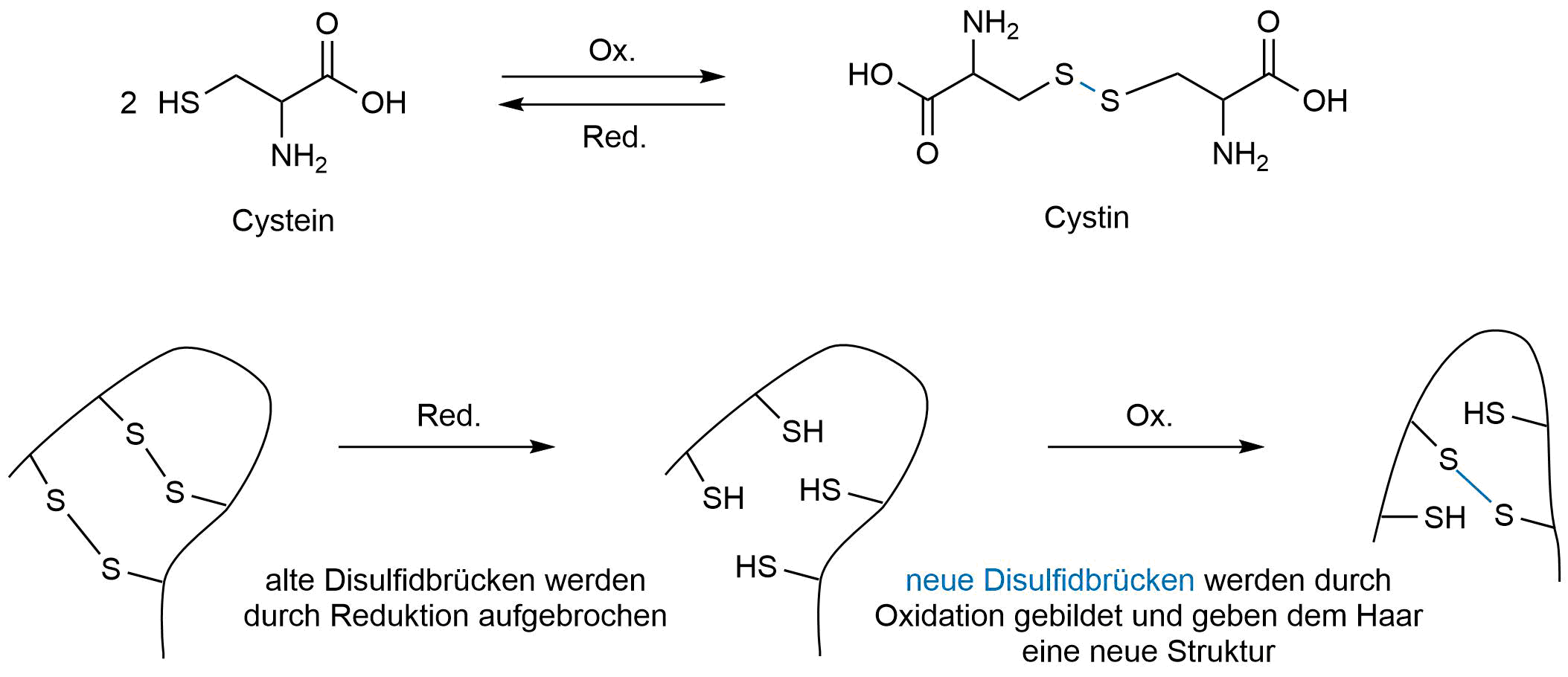
Funktionsweise einer Dauerwelle
Oxidationszahlen von Sulfiden und Disulfiden
Bei der Bestimmung der Oxidationszahl wird die Elektronegativität der
beteiligten Elemente benötigt. Hier wird auf die Elektronegativität
nach Allred und Rochow genutzt (siehe auch
scheLM
PSE.
Die Elektronegativitäten von Schwefel und Kohlenstoff sind sehr ähnlich,
in der hier verwendeten Skala nach Allred und Rochow sind sie gleich. In anderen Skalen
ist Schwefel wenig elektronegativer als Kohlenstoff, in anderen Skalen ist dies
umgekehrt. Dies hat Einfluss auf die Bestimmung der Oxidationszahl, die zentrale Aussage, das
Schwefel oxidiert wird, bleibt aber immer erhalten.
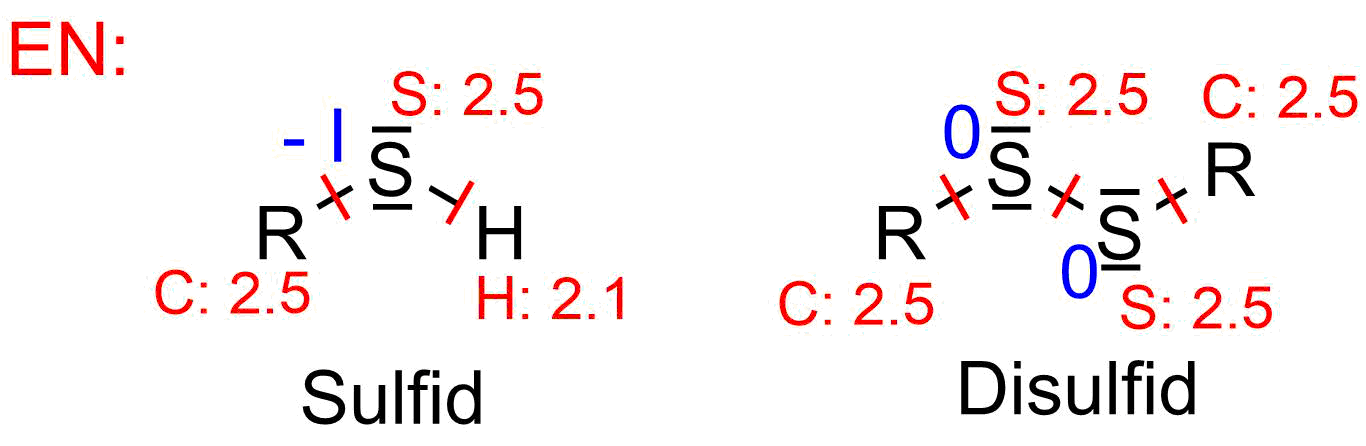
Oxidationszahlen von Sulfid und Disulfid
Links ist das Sulfid gezeigt. Schwefel und Kohlenstoff haben die gleiche
Elektronegativität (rote Zahlen), die Bindung wird homolytisch gespalten.
Schwefel bekommt ein Elektron.
Schwefel ist elektronegativer als Wasserstoff, Schwefel bekommt
zwei Elektronen aus dieser Bindung.
Schwefel hat also in Summe sieben Elektronen (drei bindende plus vier nicht bindende),
eines mehr als im neutralen Atom (sechs, da Schwefel in der sechsten Hauptgruppe steht).
Die Oxidationszahl ist also -I (blau).
Rechts ist das Disulfid gezeigt. Schwefel und Kohlenstoff haben die gleiche
Elektronegativität, daher werden die Kohlenstoff-Schwefel und die
Schwefel-Schwefel-Bindung homolytisch gesplaten. Schwefel bekommt ein Elektron pro Bindung.
Schwefel hat also sechs Aussenelektronen (zwei bindende und vier nichtbindende).
Dies entspricht der Anzahl der Elektronen im neutralen Atom.
Die Oxidationszahl ist also 0.
Bei der Bildung von Disulfiden aus Sulfiden steigt die Oxidationszahl von -I auf 0. Es handelt sich um eine Oxidation.
SN-Reaktion (Thiole)
Die Herstellung von Thiolen verläuft über eine nucleophile Substitution. Dabei stellt Hydrogensulfid HS- das angreifende Nucleophil dar. Der Angriff erfolgt an Verbindungendie eine Abgangsgruppe tragen. In dem unten dargestellten Beispiel erfolgt der Angriff des Nucleophils an einem Alkylhalogenid.
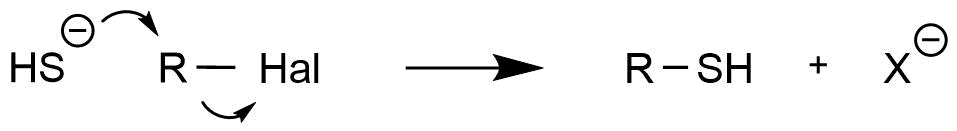
Synthese eines Thiols
Hier fehlt ein Verweis zu SN1 und SN2
SN-Reaktion (Thioether)
Die Herstellung von Thioethern ist analog zu der Herstellung von Thiolen. Auch hier handelt es sich um eine nucleophile Substitution. Zunächst erfolgt mit Hilfe von Kaliumhydroxid unter Wasserabscheidung die Bildung des Thiolats. Dieses dient als Nucleophil und greift das (positiv polarisierte) Kohlenstoffatom des Alkylhalogenids an. Das Thiolat-Anion verhält sich genauso wie das Hydrogensulfid-Anion (analoge Teilchen).
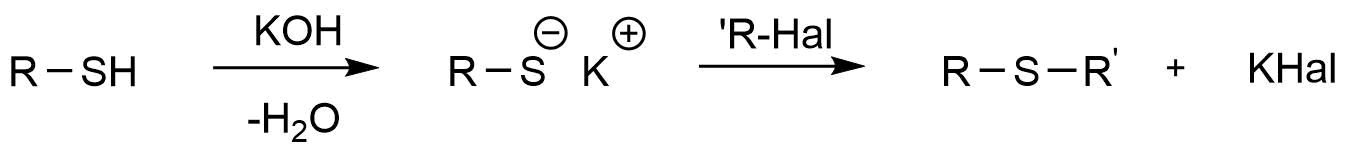
Synthese eines Thioethers
Die Synthese von Thiolen und Thiolaten verläft analog, nur mit unterschiedlichen Startmaterialien. Zu Verdeutlichung dieser Analogie ist im Folgenden nochmal die Synthese eines Thiols dargestellt.

Synthese eines Thiols
SN-Reaktion (Sulfoniumsalz)
Auf der vorherigen Seiten haben wir gezeigt, wie sich aus Thiolaten Thioether synthetisieren lassen. Auch Thioether können als Nucleophil in einer nucleophilen Substitution reagieren. Dabei entstehen aus Thioethern Sulfoniumsalze. Dies erfolgt durch Umsetzung mit einem Alkylhalogenid.
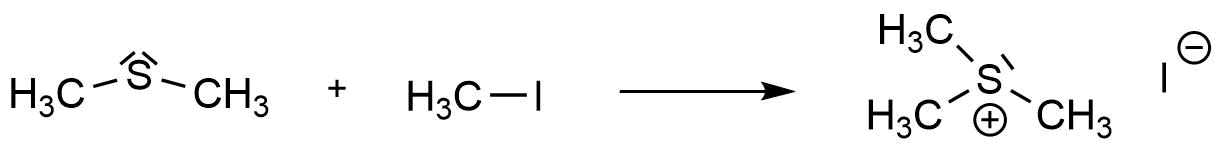
Synthese eines Sulfoniumsalzes
Das entstehende Alkylsulfoniumkation wird durch die negative Ladung des Halogenids stabilisiert und hat eine pyramidale Struktur. Die Alkylreste sind in einem 90° Winkel zueinander angeordnet. Im Vergleich zu dem typischen Tetraederwinkel von 109,45° ist dies deutlicher kleiner.
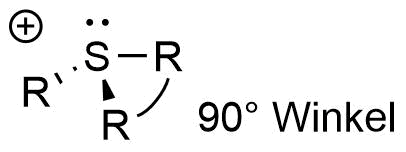
Pyramidale Sruktur eines Sulfoniumsalzes
Oxidation von Thioethern unter drastischen Bedingungen (Sulfoxide)
Unter milden Oxidationsbedingungen entstehen Disulfide (siehe Seite 2). Unter drastischen Bedingungen entstehen Sulfoxide und Sulfone (Sulfone siehe nächste Seite). Die Synthese von Sulfoxiden besteht aus der Oxidation des entsprechenden Thioethers mit Wasserstoffperoxid als Oxidationsmittel.
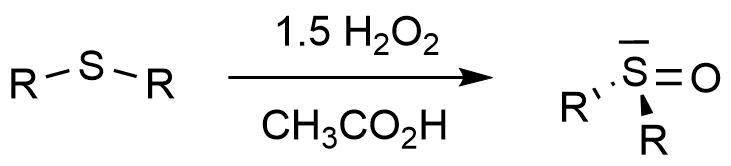
Synthese eines Sulfoxids
Durch Umklappen der Elektronenpaare kann für Sulfoxide die folgenden Grenzstrukturen formuliert werden.
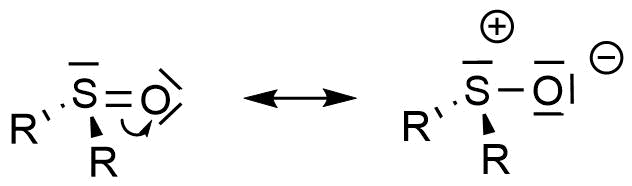
Grenzstruktur des Sulfoxids nach Umklappen der Elektronenpaare
Oxidation von Thioethern unter drastischen Bedingungen (Sulfone)
Auf der vorherigen Seite wurde die Oxidation von Thioethern zu Sulfoxiden unter drastischen Bedingungen behandelt. Sulfone lassen sich ebenfalls durch drastische Oxidation von Thioethern synthetisieren. Dabei kann als Zwischenprodukt ein Sulfoxid entstehen. Nach einem weiteren Oxidationsschritt entsteht dann das Sulfon. Als Oxidationsmittel dient auch hier Wasserstoffperoxid, sowie Kaliumpermanganat.
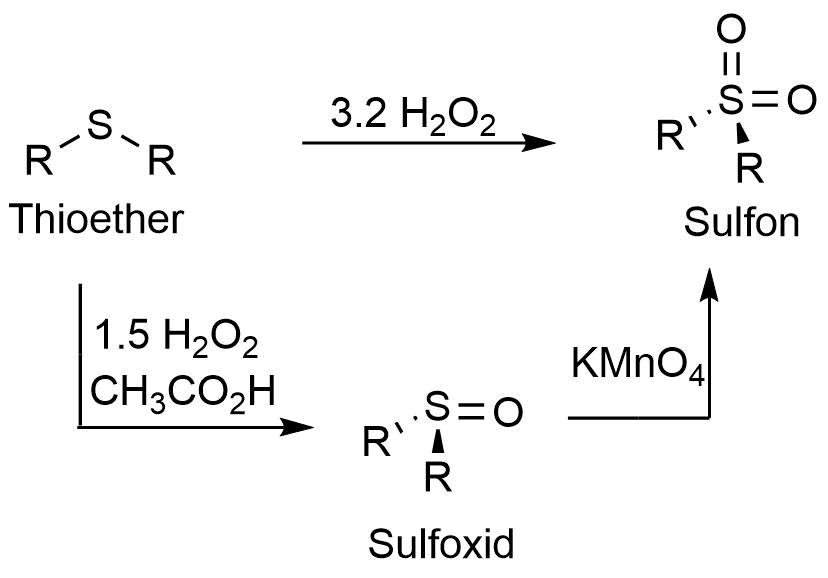
Synthese eines Sulfons
Oxidation von Thiolen unter drastischen Bedingungen (Sulfonsäuren)
Auf den vorherigen Seiten wurde die drastische Oxidation zu Sulfonen und Sulfoxiden erläutert. Zur Synthese von Sulfonsäuren gibt es mehrere Möglichkeiten: Zum Einen die Oxidation eines Thiols, zum Anderen die Sulfochlorierung (siehe nächste Seite).
Die Oxidation von Thiolen unter milden Bedingungen führt zu Disulfiden (siehe Seite 2), die Oxidation unter Einsatz von Salpetersäure führt zu Sulfonsären. In diesem Beispiel wird so Methanthiol zu Methansulfonsäure oxidiert.
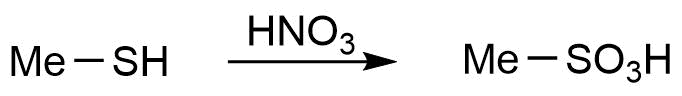
Synthese von Methansulfonsäure aus Methanthiol
Sulfochlorierung (Sulfonsäuren)
Bei der Sulfochlorierung handelt es sich eine Radikalkettenreaktion. Diese kann demnach in Start und Fortsetzung einer Radikalkettenreaktion unterteilt werden. Initiiert wird die Reaktion durch photochemische Anregung eines Chlormoleküls welches homolytisch in zwei Chlorradikale gespalten wird.
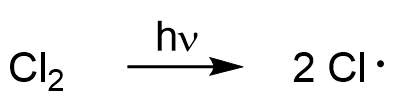
Kettenstart
Im nächsten Schritt erfolgt die Kettenfortpflanzung. Ein Chlorradikal reagiert mit einem beliebigen Alkan zu einem Allylradikal und Chlorwasserstoff. Das Allylradikal greift ein Schwefeldioxidmolekül an und es entsteht ein Alkylsulfoxidradikal. Dieses greift ein weiteres Chlormolekül an, welches in einer homolytischen Spaltung ein neues Chlorradikal, sowie ein Alkylsulfonylchlorid, generiert.
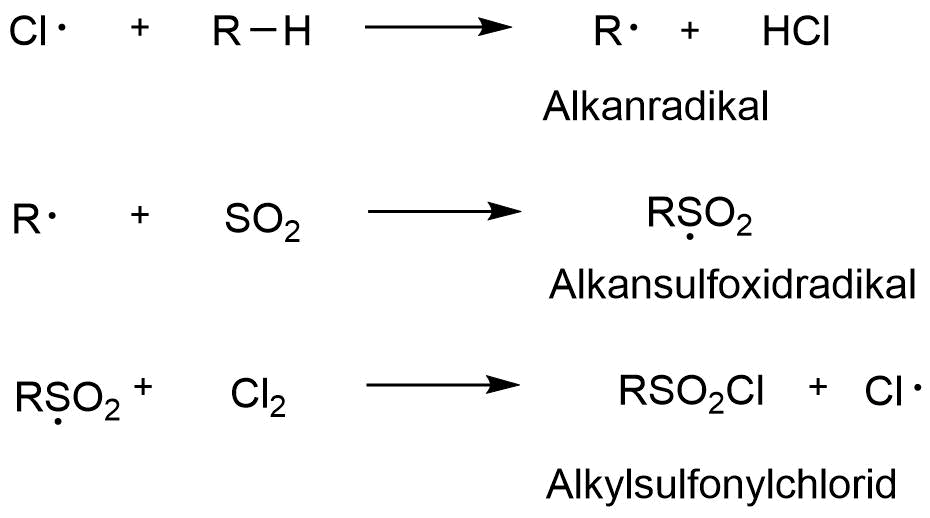
Kettenfortpflanzung
Durch Umsetzung mit Wasser und unter Abspaltung von Chlorwasserstoff entsteht aus Alkylsulfonylchlorid die entsprechende Sulfonsäure.

Umsetzung zur Säure
Oxidationszahlen von Schwefelderivaten
Unten findet Ihr eine Übersicht über die Oxidationsstufen von Schefelderivaten. Wie schon auf Seite vier in diesem Kapitel erklärt, hängt die Oxidationszahl von der verwendeten Elektronegativitätsskala ab. Hier wird die Skale nach Allred und Rochow genutzt.
In der mittleren Spalte sind die Oxidationsprodukte der Thiole aufgeführt, in der rechten Spalte die Oxidationsprodukte der Thioether. Ganz Links ist zum Vergleich noch einmal das Disulfid gezeigt.
In grau sind die Sulfensäure und die Sulfinsäure gezeigt. Diese wurden bislang nicht erwähnt und haben eine eher geringe Bedeutung in der organischen Chemie, sind aber wichtige Zwischenprodukte im Stoffwechsel. Sie wurden hier der vollständigkeithalber aufgeführt.
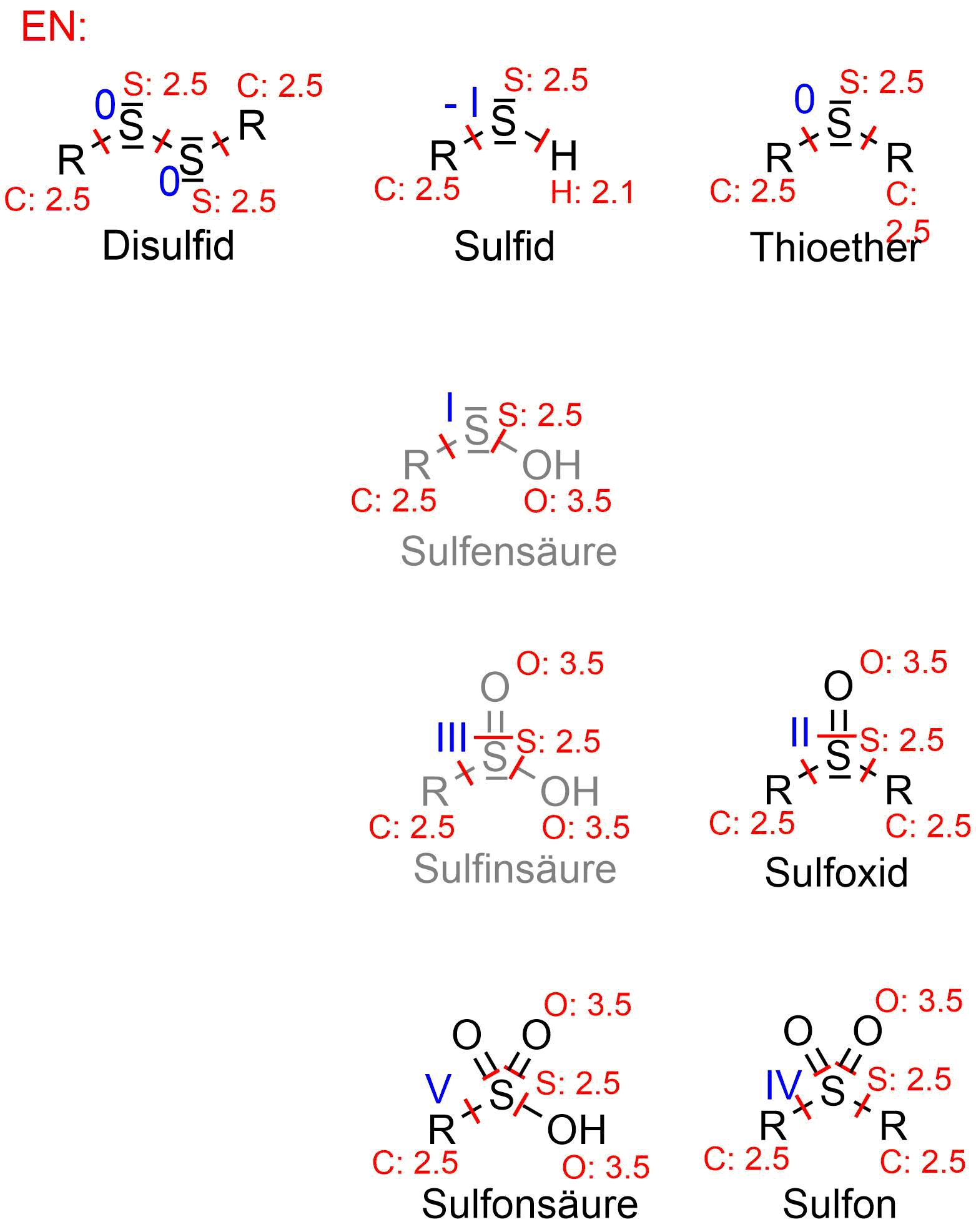
Übersicht über die Oxidationszahlen von Schwefelderivaten
Abschlusstest
scheLM LT
Es folgt ein scheLM LT-Test!
Das nächste Kapitel befasst sich mit Stickstoffverbindungen