Bitte Warten
Das Laden der Strukturdaten dauert einen Augenblick. Bitte haben Sie etwas Geduld!
0 von 0 Strukturen wurden bereits geladen.
Es ist aber wahrscheinlich, dass sich beim Umzug doch das ein oder andere Problem eingeschlichen hat. Bitte meldet Probleme inkl. möglicht genauer Beschreibung und evtl. eines Screenshots an Klaus Schaper.
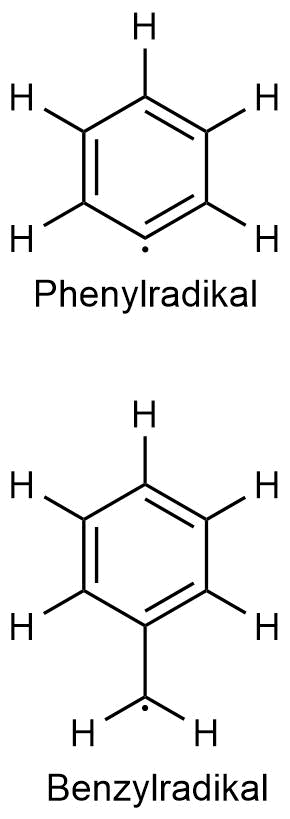
Benzyl- und Phenylrest im Vergleich
Studienfach:
Alle_Veranstaltungen
Lernziel
Das Modul aromatische Radikale vergleicht die Bindungsverhältnisse zwischen dem Phenyl- und Benzyl-Radikal.
Ziel ist es chemische Gemeinsamkeiten und Unterschiede, wie z.B. die deutlich Stabilität mit Hilfe der LCAO-Theorie erläutern zu können.
Einleitung
Radikale sind Verbindungen mit ungepaarten Valenzelektronen. Sie spielen eine wichtige Rolle als Zwischenstufen und Übergangszuständen in der Chemie. In der Regel handelt es sich dabei um sehr reaktive und dementsprechend kurzlebige Spezies. Reaktivität und Stabilität sind jedoch je nach Radikal durchaus verschieden. Sie sind u.a. abhängig von induktiven Effekten, Hyperkonjugation, der Hybridisierung des Radikalzentrums und ganz besonders von resonanzstabilisierenden Effekten.
Die beiden aromatischen Spezies, das Phenyl- (C6H5) und das Benzylradikal (C7H7) unterscheiden sich in ihrer Summenformel lediglich um eine CH2-Gruppe. Dennoch gehört das Phenylradikal zu den reaktivsten und kurzlebigsten Radikalen überhaupt, während das Benzylradikal deutlich reaktionsträger ist. Womit hängt dieses Phänomen zusammen?
- Klicken Sie nun zur Bearbeitung des Moduls auf den Start-Button, um das Textfeld und das Animationfeld korrekt auszurichten. Mit Hilfe der Pfeile links und rechts lassen sich die einzelnen Kapitel weiter- bzw. zurückblättern, oder über die Kapitel-Button direkt erreichen.
- Blauer Text entspricht Arbeitsanweisungen, kursive Textzeilen stellen Hilfestellungen und praktische Erklärungen zur Benutzung des Moduls dar, Zusammenfassungen und Merksätze sind in grau gekennzeichnet.
Das Phenylradikal
Durch die homolytische Spaltung einer C-H-Bindung an einem Benzolring erhält man ein Phenylradikal. Das ungepaarte Elektron befindet sich am Kohlenstoffatom (C6). Die Aromatizität des Ringsystems wird nicht aufgehoben bzw. beeinflusst.
- Bedienen Sie den Button zur Darstellung des ungepaarten Elektrons.
- Aktivieren Sie die drei Button zur Animation der π-Orbitale.
- Drehen Sie das Molekül und vergrößern Sie die Orbitallappen,
um die Orbitale überschneiden zu lassen.Nutzen Sie falls nötig die Zoom-Funktion (Häkchen), um das Molekül vollständig
betrachten zu können.
Tipp: Zur besseren Sichtbarkeit kann die Transparenz ausgeschaltet werden. - Schalten Sie die π-Button anschließend aus und aktivieren die C-C-σ-Bindungen
Anhand der Animation von π-Elektronensystem und ungepaartem Elektron ist ersichtlich, dass das violett dargestellte ungepaarte Elektron in einem Orbital senkrecht zu den π-Orbitalen angeordnet ist. Es liegt periplanar in der σ-Bindungsebene. Die Darstellung der C-C-σ-Bindungen (rot) lässt dies deutlich erkennen.
Da das ungepaarte Elektron nicht in einer Ebene mit dem delokalisierten π-Elektronensystem liegt, kann es nicht über resonanzstabilisierende Effekte gefestigt werden. Darüber hinaus ist das betreffende Kohlenstoffatom sp2-hybridisiert. Dies führt zu einer weiteren Destabilisierung der Radikalspezies.
Das Benzylradikal
Das Benzylradikal unterscheidet sich vom Phenylradikal darin, dass ein Wasserstoffatom durch eine Methylengruppe substituiert ist. Das ungepaarte Elektron sitzt am Kohlenstoffatom der Methylengruppe.
- Bedienen Sie den Button zur Darstellung des ungepaarten Elektrons.
- Aktivieren Sie die drei Button zur Animation der π-Orbitale.
- Drehen Sie das Molekül und vergrößern Sie die Orbitallappen, um die Orbitale überschneiden zu lassen.Nutzen Sie falls nötig die Zoom-Funktion (Häkchen), um das Molekül vollständig betrachten zu können.
- Schalten Sie die π-Button anschließend aus und aktivieren die C-C-σ-Bindungen
Die Animation des Orbitale zeigt, dass sich das ungepaarte Elektron (violett) in einer Ebene mit dem π-Elektronensystem (grün) des aromatischen Rings befindet. Die Orbitallappen des π-Elektronensystems ¨berlappen vollkommen mit dem Orbitallappen des ungepaarten Elektrons. Die σ-Bindungsebene (rot) liegt senkrecht dazu.
Aus diesem Grund liegt das ungepaarte Elektron delokalisiert über das gesamte Molekül verteilt vor. Es ist resonanzstabilisiert. Die starke Mesomeriestabilisierung sorgt dafür, dass ein Benzylradikal im Vergleich zu einem Phenylradikal um mehrere Größenordnungen besser stabilisiert und dementsprechend unreaktiver ist.
Zusammenfassung
Zusammenfassend kann man festhalten:
- Das Phenylradikal ist sehr reaktiv, da das ungepaarte Elektron in einem p-Orbital in der σ-Bindungsebene liegt.
- Das ungepaarte Elektron kann über keinerlei Effekte stabilisiert werden und befindet sich außßerdem an einem sp2-hybridisierten Kohlenstoffatom.
- Im Benzylradikal befindet sich das ungepaarte Elektron in einer Ebene mit dem π-Elektronensystem des aromatischen Rings.
- Das ungepaarte Elektron kann in diesem Fall über das gesamte Molekül delokalisiert werden und ist mesomeriestabilisiert.
- Fazit: Die starke Resonanzstabilisierung des ungepaarten Elektrons im Benzylradikal f¨hrt zu einer um mehrere Größenordnungen besseren Stabilisierung als im ebenfalls aromatischen Phenylradikal.
Ausblick: unreaktive Radikalspezies
Die Stabilität von radikalischen Spezies ist immer relativ zu sehen.
Die durchschnittliche Lebensdauer dieser Verbindungen ist bis auch wenige
Ausnahmen sehr klein, meist unter einer Sekunde.
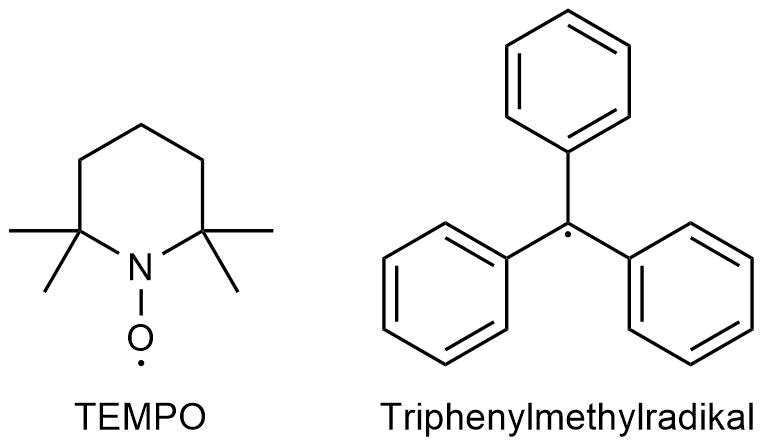
Ausnahmen sind z.B. das 2,2,6,6-Tetrametyhlpiperidinyloxyl (TEMPO)
oder das Triphenylmethyl-Radikal.
Das Triphenylmethyl-Radikal ist wie das Benzyl-Radikal durch Mesomerie sehr stark stabilisiert. Darüber hinaus steht es in Lösung mit seinem Dimer im Gleichgewicht. Das 2,2,6,6-Tetrametyhlpiperidinyloxyl (TEMPO) dagegen ist vor allem durch die sterisch anspruchsvollen Reste in der Umgebung des Radikalzentrums stabilisiert.
Die 3D-Animationen auf dieser Seite wurden mit Hilfe von JSmol erstellt: an open-source Java viewer for chemical structures in 3D. http://www.jmol.org/
scheLM 3D
scheLM Gl
scheLM I4
scheLM IR
scheLM n2s
scheLM NMR
scheLM PSE
scheLM ReRe
scheLM TV
scheLM tys
scheLM Vote
Auszeichnungen Personen Datenschutz Impressum
Wir danken dem eLearning-Förderfonds der Heinrich-Heine-Universität und dem Lehrförderungsfond der Heinrich-Heine-Universität, sowie dem Fellowship Digitale Innovation in der Hochschullehre des Landes Nordrhein-Westfalen, sowie OER-Content.NRW für die Unterstützung.
© Copyright 2013 bis 2025, PD Dr. Klaus Schaper


